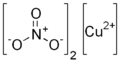Nitrato de cobre (II) para niños
Datos para niños
|
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Nitrato de cobre (II) | ||
| General | ||
| Otros nombres | Nitrato cúprico Sal de Cu(II) del ácido nítrico |
|
| Fórmula molecular | Cu(NO3)2 | |
| Identificadores | ||
| Número CAS | 10031-43-3 | |
| Propiedades físicas | ||
| Apariencia | Cristales azúles | |
| Olor | Ligero olor a ácido clorhídrico | |
| Densidad | 2320 kg/m³; 2,32 g/cm³ | |
| Masa molar | 187,56 g/mol | |
| Punto de fusión | 388,15 K (115 °C) | |
| Punto de ebullición | 443 K (170 °C) | |
| Punto de descomposición | 114,5 °C (388 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 137.8 g/100 mL a 0 °C | |
| Solubilidad | Muy soluble en etanol | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
|
|
| Ingestión | Gastritis hemorrágica, náuseas, vómitos, dolor abdominal, sabor metálico y diarrea. | |
| Inhalación | Irritación de vías respiratorias, tos, dolor de garganta y dificultad para respirar. | |
| Piel | Irritación, enrojecimiento y dolor. Puede causar alergia al cobre. | |
| Ojos | Irritación severa, enrojecimiento, dolor, visión borrosa, decoloración y posible daño ocular. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El nitrato de cobre (II), también conocido como nitrato cúprico, es un compuesto químico inorgánico. Su fórmula química es Cu(NO3)2. Este compuesto se presenta como un sólido de color azul.
Existen dos formas principales de nitrato de cobre:
- La forma anhidra, que significa que no contiene agua en su estructura.
- Las formas hidratadas, que sí contienen moléculas de agua.
Las formas hidratadas son muy comunes en los laboratorios de las escuelas. Se usan para experimentos que muestran cómo funcionan las pilas eléctricas o celdas galvánicas. El número romano (II) en su nombre indica cómo se combina el cobre en este compuesto.
Contenido
¿Qué es el Nitrato de Cobre (II)?
El nitrato de cobre (II) es un sal que se forma cuando el ácido nítrico reacciona con el cobre. Es un compuesto muy interesante por su color azul brillante y sus propiedades químicas.
Características Físicas del Nitrato de Cobre
El nitrato cúprico se puede encontrar en forma de cristales azules. Estos cristales tienen una forma alargada y un sabor metálico.
Características Químicas del Nitrato de Cobre
Cuando el nitrato de cobre se calienta en un recipiente cerrado, se derrite. Luego, se transforma en un compuesto de color verde brillante. Si se sigue calentando, se descompone por completo y se convierte en óxido cúprico.
Este compuesto es delicuescente, lo que significa que absorbe la humedad del aire y se disuelve en ella. Es más fácil de disolver en agua que en sulfato.
¿Cómo se obtiene el Nitrato de Cobre (II)?
El nitrato de cobre (II) se puede preparar de varias maneras en un laboratorio.
Preparación con Óxido de Nitrógeno
Una forma de obtener nitrato de cobre (II) es haciendo reaccionar cobre metálico con óxido de nitrógeno (IV). La reacción es la siguiente:
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
Preparación con Ácido Nítrico
También se puede preparar nitrato de cobre hidratado. Esto se logra tratando el cobre metálico con una solución de ácido nítrico diluido. La reacción es:
- Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
Preparación con Nitrato de Plata
Otra forma de obtenerlo es haciendo reaccionar cobre con una solución de nitrato de plata:
- Cu + 2 AgNO3 → Cu(NO3)2 + 2 Ag
Usos del Nitrato de Cobre (II)
El nitrato de cobre (II) tiene varios usos importantes en la química.
Producción de Ácido Nítrico
Se puede usar para producir ácido nítrico. Para esto, se calienta el nitrato de cobre hasta que se descompone. Los gases que se producen se pasan directamente por agua. Este proceso es similar a una parte del proceso de Ostwald, que es un método industrial para fabricar ácido nítrico. Las reacciones son:
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- 3 NO2 + H2O → 2 HNO3 + NO
También es interesante esta reacción:
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
Galería de imágenes
Más información
Véase también
 En inglés: Copper(II) nitrate Facts for Kids
En inglés: Copper(II) nitrate Facts for Kids