Nitrato de potasio para niños
Datos para niños
Nitrato de potasio |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Trioxonitrato (V) de potasio | ||
| General | ||
| Otros nombres | Nitrato de potasio Nitrato potásico Nitrato de potasa Salitre |
|
| Fórmula estructural | 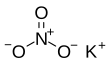 |
|
| Fórmula molecular | KNO3 | |
| Identificadores | ||
| Número CAS | 7757-79-1 | |
| Número RTECS | TT3700000 | |
| ChEBI | 63043 | |
| ChEMBL | CHEMBL1644029 | |
| ChemSpider | 22843 | |
| DrugBank | 11090 | |
| PubChem | 24434 | |
| UNII | RU45X2JN0Z | |
| KEGG | D02051 | |
|
InChI
InChI=InChI=1S/K.NO3/c;2-1(3)4/q+1;-1
Key: FGIUAXJPYTZDNR-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Blanco o gris sucio | |
| Densidad | 2100 kg/m³; 2,1 g/cm³ | |
| Masa molar | 101,103 g/mol g/mol | |
| Punto de fusión | 607 K (334 °C) | |
| Punto de ebullición | 673 K (400 °C) | |
| Estructura cristalina | Ortorrómbico, Aragonita | |
| Propiedades químicas | ||
| Solubilidad en agua | 36 g en 100g de agua | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
OX
|
|
| Riesgos | ||
| Ingestión | Puede causar irritación, náusea, vómitos, mareos y diarrea. | |
| Inhalación | Irritación; la exposición a largo plazo puede resultar fatal. | |
| Piel | Bajo riesgo. | |
| Ojos | Bajo riesgo. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El compuesto químico nitrato de potasio, componente del salitre, o nitrato potásico es un nitrato cuya fórmula es KNO3. Actualmente, la mayoría del nitrato de potasio viene de los vastos depósitos de nitrato de sodio en los desiertos chilenos. El nitrato de sodio es purificado y posteriormente se le hace reaccionar en una solución con cloruro de potasio (KCl), en la cual el nitrato de potasio, menos soluble, cristaliza.
Contenido
Historia
Antiguamente el nitrato de potasio era obtenido a partir de una mezcla de toda clase de desechos animales con escombros y cenizas vegetales, que era regada con agua de los estercoleros o con orina. De vez en cuando se raspaba la capa exterior y se lixiviaba el producto con agua. En India en cambio se ha observado que algunas plantas de hojas filiformes contienen gran cantidad de esta sal.
Síntesis
El nitrato de potasio se obtiene por neutralización de compuestos básicos (e.g. hidróxido potásico KOH) con ácido nítrico HNO3.
Se une el átomo de hidrógeno (H) del HNO3 con los átomos de hidrógeno (H) y oxígeno(O) del KOH, formando agua (H2O); y el de potasio (K) sobrante del KOH con los de nitrato (NO3) sobrantes del HNO3 :
KOH + HNO3 → H2O + KNO3
Además existe de forma natural, mineral denominado nitro, que suele estar combinado con nitratina (nitrato de sodio) formando salitre.
Propiedades
El nitrato de potasio tiene una estructura cristalina ortorrómbica a temperatura ambiente, que se transforma en un sistema trigonal a 129 °C
El nitrato de potasio es moderadamente soluble en agua, pero su solubilidad aumenta con la temperatura. La solución acuosa es casi neutra, exhibe un pH 6.2 a 14 °C para una solución al 10% de polvo comercial. No es muy higroscópico, absorbe aproximadamente 0.03% de agua en 80% de humedad relativa durante 50 días. Es insoluble en alcohol y no es venenoso; puede reaccionar explosivamente con agentes reductores, pero no es explosivo por sí mismo.
Ayudas
Aproximadamente el 75 % del nitrato de potasio se manufactura con una pureza del 90 % para su uso como fertilizante. La ausencia de cloro es una ventaja para las plantaciones de frutas cítricas y tabaco, también se usa en la producción de fertilizantes líquidos y es un importante constituyente de los fertilizantes multinutrientes. El nitrato potásico es la fuente más usada de potasio en fertirrigación, estando su consumo muy generalizado en todo tipo de cultivos, tanto anuales como permanentes. El producto al ser aplicado no deja ningún residuo, aportando solo elementos útiles, pues es soluble en su totalidad. Al aportar el nitrógeno en forma nítrica, no retenida por el suelo, su reparto es muy homogéneo. Su forma de aplicación consiste en preparar una solución madre, a partir de la cual se incorpora en el agua de riego.
El 25 % de la producción de nitrato potásico es de grado técnico, de una pureza mínima del 99 %, del cual prácticamente el 50 % es empleado en la metalurgia, principalmente en los baños de transferencia de calor, entre el 10 y 20 % es consumida por la industria del vidrio y la cerámica.
Una de las aplicaciones más útiles del nitrato de potasio es la producción de ácido nítrico, añadiendo ácido sulfúrico concentrado a una solución acuosa de nitrato de potasio. Además es una reacción endotérmica.
En conservación de alimentos, el nitrato de potasio es un ingrediente poco común de la carne salada. Como conservante es conocido como E252 (ver aditivos alimentarios).
También es un componente principal en compuestos usados para descomponer con más rapidez restos orgánicos, como los tocones de los árboles, porque acelera el proceso de descomposición.
La creencia popular dice que el nitrato de potasio es un anafrodisíaco, pero en realidad no tiene esa clase de efectos en los humanos.
Finalmente, el nitrato de potasio es el agente oxidante (aporte de oxígeno). Aunque el nitrato de potasio se usa para producir pólvora, mezclado con azufre y carbón, por sí mismo no es combustible ni inflamable.
Es bastante utilizado también para el tratamiento de la hipersensibilidad que afecta a la pulpa dental.
Véase también
 En inglés: Potassium nitrate Facts for Kids
En inglés: Potassium nitrate Facts for Kids


