Haloalcano para niños
Un haloalcano es un tipo de compuesto químico que se forma cuando uno o más átomos de hidrógeno en un alcano (un tipo de hidrocarburo simple) son reemplazados por átomos de halógeno. Los halógenos más comunes que se usan para esto son el flúor, el cloro, el bromo y el yodo. Dependiendo del halógeno, se les llama fluoroalcanos, cloroalcanos, bromoalcanos o yodoalcanos. También pueden tener una mezcla de diferentes halógenos.
Un ejemplo muy conocido de haloalcanos son los clorofluorocarburos (CFC). Estos compuestos fueron muy usados, pero se descubrió que afectaban la capa de ozono de la Tierra. Los haloalcanos se utilizan en muchas cosas, como en la fabricación de dispositivos electrónicos, como refrigerantes (para neveras y aires acondicionados), agentes espumantes (para hacer espumas), disolventes (para disolver otras sustancias), propelentes en sprays y agentes para apagar incendios.
El freon es un nombre comercial famoso para un grupo de clorofluorocarburos que se usaban mucho como refrigerantes. La palabra Freon es una marca registrada de la empresa DuPont.
Existen diferentes tipos de haloalcanos según cómo estén unidos los átomos de carbono y halógeno:
- En los haloalcanos primarios, el carbono que tiene el halógeno está unido a un solo grupo de átomos de carbono.
- En los haloalcanos secundarios, el carbono con el halógeno está unido a dos grupos de átomos de carbono.
- En los haloalcanos terciarios, el carbono con el halógeno está unido a tres grupos de átomos de carbono.
- También hay un grupo pequeño llamado halometanos, donde el halógeno está unido a un solo átomo de carbono (un grupo metilo).
Contenido
Compuestos con cloro y flúor: CFC, HCFC y HFC

Los clorofluorocarburos (CFC) son haloalcanos que contienen tanto cloro como flúor. Antes se usaban mucho en la industria, por ejemplo, como refrigerantes, propelentes en sprays y disolventes. Sin embargo, su uso ha sido prohibido en gran parte por el Protocolo de Montreal debido a que dañan la capa de ozono y contribuyen al calentamiento global.
Los hidroclorofluorocarburos (HCFC) son otro tipo de haloalcanos. A diferencia de los CFC, no todos sus hidrógenos han sido reemplazados por cloro o flúor. Se usan principalmente como sustitutos de los CFC, porque su efecto en la capa de ozono es mucho menor, aproximadamente un 10% del de los CFC.
Cuando solo el flúor reemplaza algunos hidrógenos, se les llama hidrofluorocarburos (HFC). Aunque algunos HFC pueden contribuir al calentamiento global, no afectan la capa de ozono porque no contienen cloro ni bromo, que son los elementos que causan daño a la capa de ozono en estos compuestos.
Polímeros halogenados
Algunos compuestos con flúor o cloro pueden unirse entre sí para formar cadenas muy largas, creando lo que se conoce como polímeros halogenados. Estos polímeros son muy resistentes a los productos químicos. Ejemplos importantes son el Policloruro de vinilo (PVC), que se usa en tuberías y ventanas, y el politetrafluoretileno (PTFE), más conocido como Teflón, que se usa en sartenes antiadherentes.
Historia de los haloalcanos
Primeros usos y desarrollo
El tetracloruro de carbono se usó en extintores de incendios desde finales del siglo XIX hasta el final de la Segunda Guerra Mundial. Ya en los años 20, se experimentaba con cloroalcanos para apagar fuegos en aviones militares.
En 1928, el ingeniero estadounidense Thomas Midgley creó los clorofluorocarburos (CFC). Buscaba una alternativa más segura a los refrigerantes que se usaban en ese momento, como el amoníaco, que eran tóxicos. El nuevo compuesto debía tener un punto de ebullición bajo, no ser tóxico y ser estable. Midgley demostró estas propiedades de forma espectacular: inhaló el gas y lo exhaló para apagar una vela, mostrando que no era tóxico ni inflamable.
Midgley desarrolló específicamente el CCl2F2. Sin embargo, se descubrió que existía toda una familia de estos compuestos, cada uno con un punto de ebullición diferente, lo que los hacía útiles para distintas aplicaciones. Además de como refrigerantes, los clorofluoroalcanos se usaron como propelentes en sprays, disolventes para limpiar circuitos electrónicos y agentes para producir plásticos expandidos, como el poliestireno (porexpán).
Búsqueda de alternativas
Durante la Segunda Guerra Mundial, algunos de los primeros cloroalcanos se usaban en aviones militares para apagar incendios, pero eran demasiado tóxicos. Después de la guerra, también se empezaron a usar en la aviación civil.
En los años sesenta, aparecieron los fluoroalcanos y bromofluoroalcanos, que resultaron ser muy efectivos para combatir incendios. A finales de los años 60, ya eran comunes en lugares donde el agua o los extintores de polvo seco podían dañar los objetos, como salas de computadoras, museos y colecciones de arte.
A finales de los años 70, se empezó a buscar alternativas a los CFC en refrigerantes. Esto ocurrió después de que los científicos Mario J. Molina y Frank Sherwood Rowland publicaran en 1974 sus investigaciones sobre el daño que los CFC causaban a la capa de ozono. Por su trabajo, compartieron el Premio Nobel de Química en 1995. Al añadir hidrógeno para crear hidroclorofluorocarburos (HCFC), los químicos lograron que estos compuestos fueran menos estables en la parte baja de la atmósfera, lo que permitía que se descompusieran antes de llegar a la capa de ozono. Más tarde, se crearon los hidrofluorocarburos (HFC), que no contienen cloro y tienen una vida aún más corta en la atmósfera.
A principios de los años 80, los bromofluoroalcanos (conocidos como halones) eran de uso común en aviones, barcos y vehículos grandes, así como en instalaciones informáticas y museos. Sin embargo, la preocupación por el impacto de los cloroalcanos y bromoalcanos en la capa de ozono crecía.
Reducción gradual de su uso
Actualmente, los únicos usos permitidos para los clorofluoroalcanos son en medicina, por ejemplo, en inhaladores para el asma.
El uso de ciertos cloroalcanos como disolventes en grandes aplicaciones, como la limpieza en seco, se está eliminando poco a poco debido a regulaciones ambientales.
Los bromofluoroalcanos (halones) fueron retirados de forma general en muchos países europeos antes de 2004, siguiendo el Protocolo de Montreal. Desde entonces, solo se permiten en aplicaciones muy importantes, como en la aviación o en el ámbito militar. La producción de nuevos halones cesó en la mayoría de los países a partir de 1994. Sin embargo, muchos aviones todavía necesitan sistemas de extinción de incendios basados en halón, porque aún no se ha encontrado una alternativa completamente segura y eficaz para esta aplicación. Por ello, existen programas de reciclaje de halón para gestionar de forma responsable las existencias que quedan.
Nomenclatura de los haloalcanos
Nomenclatura IUPAC
La forma oficial de nombrar los haloalcanos sigue las reglas de la nomenclatura IUPAC. Lo más común es nombrar el halógeno como un prefijo del alcano. Por ejemplo, el etano con bromo se llama bromoetano, y el metano con cuatro grupos cloro se llama tetraclorometano. También se acepta nombrarlos como "haluro de alquilo". Muchos de estos compuestos tienen nombres comunes que también son aceptados, como el cloroformo (que es triclorometano).
Nomenclatura alternativa de refrigerantes
Existe un sistema especial para nombrar los refrigerantes, que se usa principalmente para alcanos de cadena corta que contienen cloro o flúor. Este sistema es internacional y usa prefijos como:
- CFC, para clorofluorocarburos (Cl, F, C)
- HCFC, para hidroclorofluorocarburos (H, Cl, F, C)
- HFC, para hidrofluorocarburos (H, F, C)
El sistema de nomenclatura es "prefijo-01234a", donde cada número y letra indica algo sobre la composición del compuesto. Por ejemplo, CFC-11 significa que tiene 1 átomo de carbono, 0 de hidrógeno, 1 de flúor y 3 de cloro (para completar los enlaces).
Nomenclatura alternativa de halones
Este sistema fue creado por el ejército de EE. UU. para los hidrocarburos halogenados usados como agentes extintores de incendios. Al término "Halón" le sigue un número de 3, 4 o 5 cifras.
- El primer dígito es el número de átomos de carbono.
- El segundo es el número de átomos de flúor.
- El tercero es el número de átomos de cloro.
- El cuarto es el número de átomos de bromo.
- El quinto es el número de átomos de yodo.
Los ceros al final no se escriben. Por ejemplo, el Halón 1301 es el compuesto CBrF3 (bromotrifluorometano).
Cómo se fabrican los haloalcanos
Los haluros de alquilo se pueden fabricar a partir de alcanos, alquenos o alcoholes.
A partir de alcanos
Los alcanos pueden reaccionar con halógenos (como cloro y bromo) en un proceso llamado halogenación radicalaria. En esta reacción, un átomo de hidrógeno del alcano es reemplazado por un átomo de halógeno.
A partir de alquenos
Un alqueno puede reaccionar con un haluro de hidrógeno (como HCl o HBr) para formar un haloalcano. El doble enlace del alqueno se rompe y se forman dos nuevos enlaces: uno con el halógeno y otro con el hidrógeno.
Los alquenos también pueden reaccionar con halógenos (como Br2) para formar haloalcanos con dos átomos de halógeno vecinos.
A partir de alcoholes
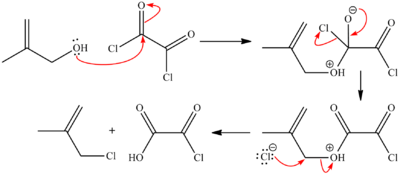
Los alcoholes pueden convertirse en haloalcanos. Por ejemplo, los alcoholes terciarios reaccionan con ácido clorhídrico para producir el cloroalcano terciario. Para alcoholes primarios o secundarios, se necesita la ayuda de otra sustancia, como el cloruro de zinc. También se pueden usar otras sustancias como el cloruro de tionilo o el tribromuro de fósforo.
Reacciones de los haloalcanos
Los haloalcanos son compuestos que reaccionan fácilmente con otras sustancias llamadas nucleófilos. Esto se debe a que el enlace entre el carbono y el halógeno está polarizado, lo que significa que el halógeno atrae más los electrones, dejando el carbono con una pequeña carga positiva, lo que lo hace atractivo para los nucleófilos.
Reacciones de sustitución
En las reacciones de sustitución, el átomo de halógeno es reemplazado por otro grupo. Un ejemplo es la hidrólisis, donde el agua rompe un enlace. Si un haloalcano reacciona con iones hidróxido (OH-), el OH- reemplaza al halógeno, formando un alcohol. Por ejemplo, el bromoetano se convierte en etanol.
La velocidad de estas reacciones depende del tamaño del halógeno: los yodoalcanos reaccionan más rápido que los fluoroalcanos.
Otros ejemplos de sustitución:
- El amoníaco puede reaccionar con bromoetano para formar diferentes tipos de etilaminas.
- El cianuro puede reaccionar con bromoetano para formar propiononitrilo.
Reacciones de eliminación
En lugar de sustituir el halógeno, se puede eliminar completamente el halógeno y un átomo de hidrógeno cercano para formar un alqueno. Por ejemplo, si el bromoetano reacciona con hidróxido de sodio, se forma etileno, agua y bromuro de sodio.
Usos de los haloalcanos
Propelentes
Los CFC se usaron mucho como propelentes en inhaladores para el asma. Ahora se están reemplazando por otros halocarburos que no dañan la capa de ozono.
Refrigerantes
Un refrigerante es una sustancia que cambia de gas a líquido y viceversa en un ciclo térmico, como en neveras y aires acondicionados. Los CFC aparecieron en los años 30 y reemplazaron a refrigerantes peligrosos como el amoníaco, porque eran seguros, poco tóxicos y fáciles de usar. Sin embargo, debido a su daño a la capa de ozono, su uso en nuevas instalaciones está prohibido desde mediados de los 90. Los HCFC también están prohibidos en equipos nuevos, aunque se pueden usar por un tiempo limitado para recargas. Una alternativa actual son los HFC.
Agentes espumantes
Un agente espumante es un material que produce gas bajo ciertas condiciones, como altas temperaturas, para formar espuma y aumentar el volumen de un material. Antes se usaba mucho el CFC-11, luego el HCFC-141b. Hoy en día, se usan HFCs, hidrocarburos o tecnologías basadas en CO2, agua o aire.
Extinción de incendios
A altas temperaturas, los halones se descomponen y liberan átomos de halógeno que apagan el fuego al detener la reacción química de la llama. Son muy efectivos y no dañan los objetos. Sin embargo, debido a que son perjudiciales para la capa de ozono, su uso actual se limita a situaciones muy importantes, como en centrales nucleares, aviación y aplicaciones militares.
Disolventes
En el pasado, el metilcloroformo y el CFC-113 se usaban mucho para limpiar metales y componentes electrónicos. Debido a sus efectos dañinos en la capa de ozono, su uso está prohibido desde mediados de los 90. Se han usado HCFC como sustitutos temporales, pero también se están eliminando. Otras alternativas incluyen HFCs, hidrofluoroéteres, disolventes clorados, hidrocarburos y disolventes oxigenados, así como sistemas de limpieza con agua.
Control de plagas
El bromuro de metilo se ha usado para fumigar suelos y controlar plagas en la agricultura. En la Unión Europea, su uso está limitado y controlado solo para usos muy importantes.
Véase también
 En inglés: Haloalkane Facts for Kids
En inglés: Haloalkane Facts for Kids