Bicarbonato de sodio para niños
Datos para niños
Bicarbonato de sodio |
||
|---|---|---|
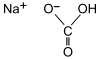 Estructura molecular
|
||
 Cristales de NaHCO3
|
||
 |
||
| Nombre IUPAC | ||
| Hidrogenocarbonato (IV) de sodio | ||
| General | ||
| Otros nombres | Carbonato ácido de sodio Hidrogenocarbonato de sodio |
|
| Fórmula molecular | NaHCO3 | |
| Identificadores | ||
| Número CAS | 144-55-8 | |
| ChEBI | 32139 | |
| ChEMBL | CHEMBL1353 | |
| ChemSpider | 8609 | |
| DrugBank | DB01390 | |
| PubChem | 516892 | |
| UNII | 8MDF5V39QO | |
| KEGG | D01203 C12603, D01203 | |
|
InChI
InChI=InChI=1S/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1
Key: UIIMBOGNXHQVGW-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | Blanco cristalino | |
| Densidad | 2173 kg/m³; 2,173 g/cm³ | |
| Masa molar | 84,01 g/mol | |
| Punto de fusión | 323,15 K (50 °C) | |
| Punto de descomposición | 543,15 K (270 °C) | |
| Índice de refracción (nD) | 1,3344 | |
| Propiedades químicas | ||
| Acidez | 10.329 pKa | |
| Solubilidad en agua | 10,3 g⁄100 g de H2O | |
| Termoquímica | ||
| ΔfH0sólido | -951 kJ/mol | |
| S0sólido | 102 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
0
1
|
|
| Riesgos | ||
| Riesgos principales | HSci - Safety data | |
| Ingestión | No peligroso excepto en cantidades muy grandes | |
| Inhalación | Puede causar irritación | |
| Piel | Puede causar irritación | |
| Ojos | Puede causar ceguera | |
| LD50 | 4220 mg/kg | |
| Más información | Hazardous Chemical Database (en inglés) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El bicarbonato de sodio es un compuesto químico muy conocido. Es un polvo blanco que se disuelve en agua. Tiene un sabor ligeramente salado y se parece al carbonato de sodio, pero es más suave. Su fórmula química es NaHCO3. Puedes encontrarlo de forma natural como un mineral llamado nahcolita o se puede fabricar. También es parte de un mineral llamado natrón y se halla en algunos manantiales de agua.
Cuando el bicarbonato de sodio se mezcla con un ácido, se descompone. Esta reacción produce dióxido de carbono (un gas) y agua, creando burbujas. Por eso se usa en la panadería para hacer que las masas crezcan y en las gaseosas. Algunas levaduras para hornear contienen bicarbonato de sodio.
También es un ingrediente principal en los polvos que se usan en los extintores de incendios.
Contenido
- ¿Qué es el Bicarbonato de Sodio y cómo se le conoce?
- ¿Cómo se obtiene el Bicarbonato de Sodio?
- Usos del Bicarbonato de Sodio en la vida diaria
- Usos en la Cocina
- Otros Usos Importantes
- ¿Para qué sirve el Bicarbonato en la Pirotecnia?
- ¿Es el Bicarbonato un Desinfectante Suave?
- ¿Cómo se usa el Bicarbonato en Extintores de Incendios?
- ¿Cómo Neutraliza Ácidos el Bicarbonato?
- ¿Se usa el Bicarbonato en el Deporte?
- ¿Tiene Usos en la Agricultura?
- Usos en la Salud y la Higiene Personal
- ¿Se usa el Bicarbonato para Limpiar?
- ¿Ayuda el Bicarbonato a Controlar Olores?
- ¿Se usa el Bicarbonato para producir Gas Hidrógeno?
- Véase también
¿Qué es el Bicarbonato de Sodio y cómo se le conoce?
El bicarbonato de sodio tiene muchos nombres porque se ha usado por mucho tiempo. Algunos de ellos son bicarbonato sódico, hidrogenocarbonato de sodio o carbonato ácido de sodio. En algunos lugares, como Estados Unidos, se le llama "baking soda". En otros, como el Reino Unido, se le conoce como "bicarbonate of soda".
Su número E como aditivo alimentario es E500.
En el año 1791, un químico francés llamado Nicolas Leblanc produjo carbonato de sodio. Más tarde, en 1801, el farmacéutico alemán Valentin Rose el Joven descubrió el bicarbonato de sodio en Berlín.
En 1846, dos panaderos de Estados Unidos, Austin Church y John Dwight, abrieron la primera fábrica en su país. Allí producían bicarbonato de sodio a partir de carbonato de sodio y dióxido de carbono.
¿Cómo se obtiene el Bicarbonato de Sodio?
El bicarbonato de sodio se puede obtener a través de un proceso llamado proceso de Solvay. Este proceso se usa principalmente para hacer carbonato de sodio, pero en una de sus etapas se produce bicarbonato de sodio. La reacción principal es:
- Cloruro de sodio (sal común) + Amoníaco + Dióxido de carbono + Agua → Bicarbonato de sodio + Cloruro de amonio
En esta reacción, el bicarbonato de sodio se separa y se puede recolectar.
Usos del Bicarbonato de Sodio en la vida diaria
Usos en la Cocina
¿Cómo ayuda el Bicarbonato a que los alimentos crezcan?
En la cocina, el bicarbonato de sodio se usa para que las masas "suban" o se hagan más grandes. Cuando se mezcla con un ingrediente ácido, libera dióxido de carbono. Este gas crea burbujas en la masa, haciendo que pasteles, panes y otros productos horneados queden esponjosos. Algunos ingredientes ácidos que lo activan son el jugo de limón, el yogur o el vinagre.
El calor también puede hacer que el bicarbonato de sodio libere dióxido de carbono. Esto ocurre a temperaturas mayores de 80 °C. Si se usa solo, sin un ácido, puede dejar un sabor amargo en la comida.
¿Qué es el Polvo de Hornear?
El polvo de hornear es un producto que se usa para cocinar y contiene bicarbonato de sodio. También incluye varios ingredientes ácidos que se activan al añadir agua. Esto significa que no necesitas añadir más ácidos a tu receta. El bicarbonato de sodio es alcalino, y el ácido en el polvo de hornear evita que la comida tenga un sabor metálico.
Otros Usos Importantes
¿Para qué sirve el Bicarbonato en la Pirotecnia?
El bicarbonato de sodio es un ingrediente clave en algunos fuegos artificiales, como los que forman una "serpiente negra". Cuando se calienta, libera dióxido de carbono. Este gas ayuda a crear una larga "serpiente" de ceniza. También se usa para hacer más lentas las reacciones de combustión, ya que el CO2 y el agua que libera actúan como retardantes de llama.
¿Es el Bicarbonato un Desinfectante Suave?
Sí, el bicarbonato de sodio tiene propiedades desinfectantes suaves. También puede ayudar a combatir algunos hongos. Además, es bueno para absorber olores, por ejemplo, para quitar el olor a humedad de los libros viejos.
¿Cómo se usa el Bicarbonato en Extintores de Incendios?
Puedes usar bicarbonato de sodio para apagar pequeños incendios de grasa o eléctricos. Al arrojarlo sobre el fuego, el calor hace que libere dióxido de carbono, que ayuda a sofocar las llamas. Sin embargo, no se debe usar en freidoras, ya que el gas podría hacer que la grasa caliente salpique. Se usa en extintores de polvo químico seco para fuegos de clase BC.
¿Cómo Neutraliza Ácidos el Bicarbonato?
El bicarbonato de sodio reacciona con los ácidos, liberando gas CO2. Por eso se usa en laboratorios para neutralizar derrames de sustancias ácidas. Es muy útil para esto.
¿Se usa el Bicarbonato en el Deporte?
Algunos atletas usan bicarbonato de sodio como suplemento para mejorar la resistencia de sus músculos. Los estudios sugieren que puede ser útil para la resistencia de grupos musculares pequeños y grandes.
¿Tiene Usos en la Agricultura?
Cuando se aplica bicarbonato de sodio en las hojas de las plantas, puede ayudar a prevenir el crecimiento de hongos. Sin embargo, no los elimina por completo. Si se usa demasiado, puede causar manchas en las frutas o decoloración en las hojas.
Usos en la Salud y la Higiene Personal
El bicarbonato de sodio mezclado con agua se puede usar como antiácido para aliviar la indigestión y la acidez estomacal. Reacciona con el ácido del estómago, produciendo sal, agua y dióxido de carbono.
También se usa en algunos enjuagues bucales. Ayuda a limpiar los dientes y las encías, neutraliza el ácido en la boca y puede prevenir infecciones. Además, se puede combinar con sal para hacer una solución para la limpieza nasal.
Se utiliza en la higiene de los ojos para tratar una condición llamada blefaritis.
¿Se usa el Bicarbonato para Limpiar?
El bicarbonato de sodio se usa en un proceso llamado "chorreado con bicarbonato" para quitar pintura o corrosión. Es suave y no daña superficies delicadas como el aluminio o la madera.
Una pasta de bicarbonato de sodio con un poco de agua es un limpiador suave. Puede ayudar a quitar el óxido superficial. También se añade a las lavadoras para quitar olores de la ropa. Es eficaz para limpiar manchas de té y café de las tazas.
Durante el Proyecto Manhattan, se descubrió que el bicarbonato de sodio ayudaba a eliminar el uranio de la ropa.
¿Ayuda el Bicarbonato a Controlar Olores?
Se dice que el bicarbonato de sodio es bueno para eliminar olores. Por eso, a veces se recomienda poner una caja abierta en el refrigerador para absorber los malos olores. Esta idea se hizo muy popular gracias a una campaña publicitaria.
¿Se usa el Bicarbonato para producir Gas Hidrógeno?
El bicarbonato de sodio puede actuar como un catalizador en la producción de gas hidrógeno. Esto se hace mediante un proceso llamado electrólisis del agua, donde la electricidad separa el hidrógeno del oxígeno. Es una demostración común en las clases de química.
Véase también
 En inglés: Sodium bicarbonate Facts for Kids
En inglés: Sodium bicarbonate Facts for Kids
- Bicarbonato
- Levadura
- Lista de minerales
- Carbonato de sodio
- Ácido carbónico


