Proceso Solvay para niños
El método Solvay es un proceso químico muy importante que se usa para fabricar carbonato de sodio a gran escala. El carbonato de sodio, también conocido como ceniza de sosa, es un material que se utiliza en muchas industrias, como la fabricación de vidrio, jabones y productos para limpiar.
Este método fue descubierto por un científico llamado Schloesing, pero él no pudo aplicarlo en la industria. Más tarde, un empresario y persona generosa de Bélgica llamado Ernest Solvay estudió y mejoró este proceso, y por eso lleva su nombre.
Contenido
¿Qué es el carbonato de sodio y para qué sirve?
El carbonato de sodio es un compuesto químico que se ve como un polvo blanco. Es muy útil en la vida diaria y en la industria.
Usos principales del carbonato de sodio
- Fabricación de vidrio: Es uno de los ingredientes principales para hacer vidrio.
- Jabones y detergentes: Ayuda a que los jabones y detergentes limpien mejor.
- Tratamiento de agua: Se usa para ablandar el agua dura, lo que significa que elimina minerales que pueden causar problemas en tuberías y electrodomésticos.
¿Cómo funciona el método Solvay?
El método Solvay es un ciclo de reacciones químicas que utiliza materiales comunes para producir carbonato de sodio de manera eficiente.
Pasos clave del proceso Solvay
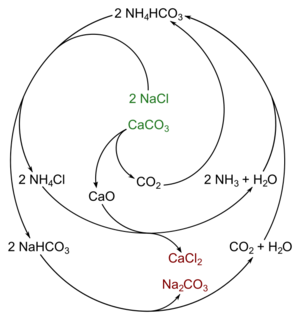
1. Mezcla de gases y sal: Se hace pasar amoníaco (un gas) y dióxido de carbono (otro gas) a través de una solución concentrada de cloruro de sodio (sal común). * Esta mezcla forma dos nuevos compuestos: hidrogenocarbonato de sodio y cloruro de amonio. Ambos se disuelven en agua. * <chem>NaCl + NH3 + CO2 + H2O --> NaHCO3 + NH4Cl</chem>
2. Separación y calentamiento: El hidrogenocarbonato de sodio se separa de la solución mediante un proceso llamado filtración. Luego, se calienta a altas temperaturas (calcinación). * Al calentarse, el hidrogenocarbonato de sodio se transforma en carbonato de sodio, que es el producto final deseado. También se liberan agua y dióxido de carbono. * <chem>2 NaHCO3 --> Na2CO3 + H2O + CO2</chem>
3. Recuperación de amoníaco: El cloruro de amonio que se formó en el primer paso se mezcla con hidróxido de calcio. * Esta reacción permite recuperar el amoníaco, que puede ser reutilizado en el primer paso del proceso, haciendo que sea más eficiente. * <chem>2 NH4Cl + Ca(OH)2 --> 2 NH3 + 2 H2O + CaCl2</chem>
4. Producción de dióxido de carbono y óxido de calcio: El dióxido de carbono necesario para el primer paso se obtiene calentando piedra caliza (carbonato de calcio) en la misma fábrica. * Al calentar la piedra caliza, se produce óxido de calcio y dióxido de carbono. El óxido de calcio se usa para producir el hidróxido de calcio del paso anterior. * <chem>CaCO3 -> CaO + CO2</chem>
Este ciclo de reacciones hace que el método Solvay sea muy eficiente, ya que muchos de los materiales se reciclan dentro del mismo proceso.
Historia y desarrollo
El método Solvay fue un gran avance en la industria química. Antes de su invención, el carbonato de sodio se producía con un método más antiguo llamado Proceso Leblanc, que era menos eficiente y generaba más residuos. El método Solvay revolucionó la producción de este químico esencial, haciéndola más limpia y económica.
Véase también
 En inglés: Solvay process Facts for Kids
En inglés: Solvay process Facts for Kids
- Proceso Leblanc