Óxido de zinc para niños
Datos para niños
Óxido de zinc |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Óxido de zinc | ||
| General | ||
| Otros nombres | Monóxido de zinc, óxido zínquico | |
| Fórmula molecular | ZnO | |
| Identificadores | ||
| Código ATC | A07XA91 | |
| Número CAS | 1314-13-2 | |
| Número RTECS | ZH4810000 | |
| ChEBI | 36560 | |
| ChEMBL | 3988900 | |
| ChemSpider | 14122 | |
| DrugBank | DB09321 | |
| PubChem | 14806 | |
| UNII | SOI2LOH54Z | |
| KEGG | C12570 | |
|
[Zn]=O
|
||
|
InChI
InChI=1S/O.Zn
Key: XLOMVQKBTHCTTD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Sólido blanco: 4.95, 12.8  | |
| Olor | Inodoro | |
| Densidad | 5600 kg/m³; 5,6 g/cm³ | |
| Masa molar | 81,406 g/mol | |
| Punto de fusión | 2248 K (1975 °C) | |
| Punto de ebullición | 2633 K (2360 °C) | |
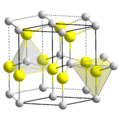
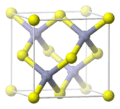
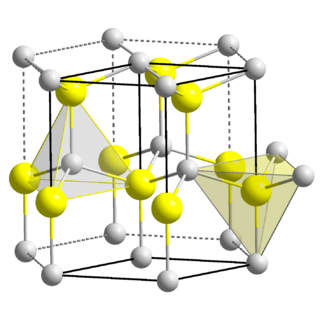
| Estructura cristalina | Hexagonal (tipo wurtzita): 4.145  | |
| Índice de refracción (nD) | n1=2.013, n2=2.029 : 4.138, 10.251  | |
| Conductividad térmica | 0.6 W/(cm·K) | |
| Banda prohibida | 3.2 eV | |
| Propiedades químicas | ||
| Solubilidad en agua | 1.6 mg/L a 29 °C | |
| Termoquímica | ||
| ΔfH0sólido | −350.46±0.27 kJ mol−1 kJ/mol | |
| S0sólido | 43.65±0.40 J·mol–1·K–1 | |
| Capacidad calorífica (C) | 40.3 J·mol-1·K-1 | |
| Peligrosidad | ||
| SGA |  |
|
| Punto de inflamabilidad | 1436 K (1163 °C) | |
| NFPA 704 |
0
2
0
|
|
| Frases H | H400, H401 | |
| Frases P | P273, P391, P501 | |
| Riesgos | ||
| LD50 | 7950 mg/kg (ratas, oral) | |
| Compuestos relacionados | ||
| Compuestos con cloro | Clorato de zinc Cloruro de zinc |
|
| Compuestos con azufre | Sulfato de zinc Sulfuro de zinc |
|
| Otros aniones | Seleniuro de zinc Telururo de zinc |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El óxido de zinc es un compuesto inorgánico con la fórmula química ZnO. Se presenta como un polvo blanco que no se disuelve en agua. Es un material muy útil que se añade a muchos productos.
Puedes encontrar óxido de zinc en el caucho, plásticos, cerámicas, vidrio, cemento y lubricantes. También se usa en pinturas, ungüentos, adhesivos, selladores y pigmentos. Incluso se añade a suplementos alimenticios, baterías y cintas de primeros auxilios. Aunque existe de forma natural en un mineral llamado cincita, la mayoría del óxido de zinc se fabrica en laboratorios.
El ZnO es un tipo de semiconductor especial. Tiene propiedades muy buenas, como ser transparente, permitir que los electrones se muevan fácilmente y brillar intensamente a temperatura ambiente. Por eso, es importante para pantallas, ventanas que ahorran energía y aparatos electrónicos como transistores y diodos de luz.
Contenido
Óxido de Zinc: Un Compuesto Versátil
¿Qué es el Óxido de Zinc?
El óxido de zinc es un compuesto químico formado por zinc y oxígeno. Su fórmula es ZnO. Es conocido por ser un polvo blanco que no se mezcla con el agua. Este material es muy importante en la industria y en la vida diaria.
Un Vistazo a su Historia
El óxido de zinc se ha usado desde hace mucho tiempo. Los primeros humanos probablemente lo usaban como pintura o para cuidar la piel.
Usos Antiguos y Medicinales
En la antigua India, alrededor del año 500 a.C., se mencionaba el uso de un bálsamo para los ojos y heridas que probablemente era óxido de zinc. El médico griego Dioscórides (siglo I d.C.) también lo mencionó. Más tarde, en el año 1025 d.C., el médico Avicena lo recomendó para diversas afecciones de la piel.
Hoy en día, el óxido de zinc se sigue usando para muchos problemas de la piel. Lo encuentras en polvos para bebés, cremas para rozaduras, lociones como la calamina y champús para la caspa. También está en ungüentos que ayudan a prevenir infecciones.
Los romanos fabricaban latón (una mezcla de zinc y cobre) usando óxido de zinc desde el año 200 a.C. Se cree que lo obtenían calentando minerales de zinc. Este proceso fue descrito por Dioscórides. También se ha encontrado óxido de zinc en minas antiguas de la India.
El Óxido de Zinc en la Pintura
Entre los siglos XII y XVI, el zinc y el óxido de zinc se producían en la India. En el siglo XVII, esta fabricación llegó a China. En Europa, la primera fábrica de zinc se abrió en Bristol, Reino Unido, en 1743.
En 1782, se propuso usar óxido de zinc como pigmento blanco en pinturas, en lugar de un pigmento de plomo que era tóxico. El óxido de zinc, conocido como "blanco de zinc", se aceptó como pigmento en pinturas al óleo en 1834.
El blanco de zinc era mejor que el blanco de plomo porque no era tóxico, no se ponía oscuro con el aire y era más barato. Además, era muy útil para mezclar con otros colores. Sin embargo, a veces las pinturas hechas solo con blanco de zinc se agrietaban con el tiempo.
Más recientemente, el óxido de zinc se ha usado mucho en la industria del caucho para hacerlo más resistente. En los años 70, también se usaba en la fotocopia, pero luego fue reemplazado por el titanio.
¿Cómo se Produce el Óxido de Zinc?
Cada año se producen muchísimas toneladas de óxido de zinc para la industria. Hay tres métodos principales para hacerlo.
Proceso Indirecto (Francés)
En este método, el zinc metálico se derrite y se convierte en vapor a temperaturas muy altas (cerca de 1000 °C). Este vapor de zinc reacciona con el oxígeno del aire para formar óxido de zinc. Las partículas de óxido se enfrían y se recogen. Este es el método más usado en el mundo.
Proceso Directo (Americano)
Este proceso usa materiales de zinc que no son tan puros, como minerales o residuos. Estos materiales se calientan con carbón para producir vapor de zinc, que luego se oxida igual que en el proceso indirecto. El producto final de este método no es tan puro.
Proceso Químico Húmedo
Una pequeña parte del óxido de zinc se produce con este método. Se parte de soluciones de sales de zinc purificadas. De estas soluciones se obtiene un precipitado (una sustancia sólida que se separa del líquido), que luego se filtra, se lava, se seca y se calienta a unos 800 °C.
Fabricación en Laboratorio
Para estudios científicos o usos especiales, el óxido de zinc se puede producir de muchas maneras en el laboratorio. Se pueden obtener cristales grandes o películas delgadas.
Un método sencillo en el laboratorio es electrolizar una solución de bicarbonato de sodio con un electrodo de zinc. Esto produce hidróxido de zinc, que al calentarse se convierte en óxido de zinc.
Nanoestructuras de Óxido de Zinc
El óxido de zinc también se puede fabricar en formas muy pequeñas, llamadas nanoestructuras. Estas pueden ser como cables diminutos, bastones, cintas o partículas. Se pueden crear con métodos económicos y respetuosos con el ambiente, a bajas temperaturas.
Estas nanoestructuras son muy útiles para nuevas tecnologías, como las celdas solares y los dispositivos que emiten luz.
Propiedades del Óxido de Zinc
El óxido de zinc tiene características físicas y químicas interesantes.
Propiedades Físicas
El ZnO puro es un polvo blanco. Sin embargo, el mineral natural cincita puede tener un color amarillo o rojo debido a otras sustancias.
Una curiosidad es que el óxido de zinc cambia de color de blanco a amarillo cuando se calienta en el aire, y vuelve a ser blanco al enfriarse. Esto se debe a pequeños cambios en su composición.
El óxido de zinc es un material relativamente blando, con una dureza de 4.5 en la escala de Mohs. También tiene una alta capacidad para almacenar calor y conducir el calor.
Propiedades Químicas
El óxido de zinc es un óxido anfótero, lo que significa que puede reaccionar tanto con ácidos como con bases. Es casi insoluble en agua, pero se disuelve en la mayoría de los ácidos. Por ejemplo, con ácido clorhídrico reacciona así:
- ZnO + 2 HCl → ZnCl2 + H2O
También reacciona con bases para formar otras sustancias. Cuando se mezcla con una solución fuerte de cloruro de zinc, forma un material parecido al cemento que se usaba en odontología.
El óxido de zinc se descompone en vapor de zinc y oxígeno a temperaturas muy altas (alrededor de 1975 °C). Si se calienta con carbón, se convierte en vapor de zinc a temperaturas más bajas (cerca de 950 °C).
Puede reaccionar de forma fuerte con polvo de aluminio y magnesio, o con caucho clorado y aceite caliente, lo que puede causar incendios. También reacciona con sulfuro de hidrógeno para formar sulfuro de cinc, una reacción que se usa en la industria.
Usos Comunes del Óxido de Zinc
Las aplicaciones del óxido de zinc son muchas. Se usa en diversos productos por su capacidad de reaccionar con otras sustancias, su alto índice de refracción, su buena conducción de calor, sus propiedades para combatir bacterias y su protección contra los rayos UV.
En la Fabricación de Caucho
Entre el 50% y el 60% del óxido de zinc producido se usa en la industria del caucho. Se añade junto con ácido esteárico para hacer que el caucho sea más fuerte y elástico (proceso llamado vulcanización). También ayuda a proteger el caucho de hongos y de la luz ultravioleta.
En la Industria Cerámica
La industria de la cerámica usa mucho óxido de zinc, especialmente en esmaltes y piezas horneadas. Sus propiedades de calor y estabilidad son útiles para la cerámica. El ZnO ayuda a que los esmaltes sean más elásticos y evita que se agrieten. También puede hacer que las superficies sean brillantes o mates, dependiendo de la cantidad.
Usos en Medicina y Cuidado Personal
El óxido de zinc es un ingrediente clave en muchos productos para el cuidado de la piel.
- La calamina es una mezcla de óxido de zinc con un poco de óxido de hierro, usada en lociones para calmar la piel.
- Cuando se mezcla con eugenol, forma un material usado en odontología.
- Sus partículas finas tienen propiedades que combaten bacterias y malos olores. Por eso se añaden a telas de algodón, productos para la boca y envases de alimentos.
- Se usa en polvos para bebés, cremas para rozaduras, champús anti-caspa y ungüentos para prevenir infecciones.
- Los atletas lo usan en cintas para proteger los tejidos blandos.
- Es un ingrediente importante en los protectores solares. Bloquea los rayos UVA y UVB del sol, protegiendo la piel de quemaduras. Es considerado seguro y no irritante. Algunos protectores solares usan nano partículas de óxido de zinc para que no se vean blancas en la piel.
Como Pigmento y Protector Solar
El "blanco de zinc" se usa como pigmento en pinturas. Es más opaco que otros pigmentos blancos y se usa para recubrir papel. Un tipo especial, llamado "blanco chino", es usado por artistas. Muchos pintores famosos lo usaron en sus obras. También es un ingrediente principal en el maquillaje mineral.
El óxido de zinc en tamaño muy pequeño (micronizado o nano escala) ofrece una gran protección contra la radiación ultravioleta. Por eso se usa en lociones bronceadoras y en lentes de sol especiales para proteger los ojos en el espacio o al soldar.
Otros Usos Importantes
- Revestimientos protectores: Las pinturas con óxido de zinc protegen los metales de la corrosión, especialmente el hierro.
- Ventanas inteligentes: El óxido de zinc con otros elementos se usa en ventanas que ahorran energía. Estas ventanas dejan pasar la luz visible, pero reflejan el calor, manteniendo las habitaciones frescas o cálidas.
- Protección de plásticos: Se aplica una capa de óxido de zinc a plásticos como el PEN y el policarbonato para protegerlos de la luz solar y evitar que se deterioren.
- Reactores nucleares: Una forma especial de óxido de zinc se usa para prevenir la corrosión en algunos tipos de reactores nucleares.
- Purificación de gas: El óxido de zinc se usa para eliminar el sulfuro de hidrógeno de gases como el gas natural, lo que es importante antes de otros procesos industriales.
Aplicaciones Futuras del Óxido de Zinc
El óxido de zinc tiene un gran potencial para el futuro en varias áreas.
En Electrónica y Sensores
El ZnO es prometedor para fabricar diodos láser y diodos emisores de luz (LEDs) debido a sus propiedades especiales de luz. También es resistente a la radiación, lo que lo hace útil para aplicaciones en el espacio.
Se pueden crear transistores transparentes usando óxido de zinc. Además, las capas de ZnO con aluminio son electrodos transparentes más económicos y menos tóxicos que otros materiales.
Los sensores hechos con nano bastones de óxido de zinc pueden detectar cambios en la corriente eléctrica cuando absorben moléculas de gas, como el hidrógeno.
Generación de Energía
Se ha descubierto que las fibras textiles cubiertas con óxido de zinc pueden generar electricidad a partir del movimiento o del aire. En 2008, científicos crearon un pequeño generador que produce electricidad al estirar y soltar nano cables de óxido de zinc, convirtiendo energía mecánica en eléctrica.
¿Es Seguro el Óxido de Zinc?
El óxido de zinc es considerado seguro como aditivo alimentario por la FDA (Administración de Alimentos y Medicamentos de EE. UU.).
Sin embargo, es peligroso inhalar los vapores de óxido de zinc. Estos vapores se producen cuando el zinc o sus aleaciones se derriten y se oxidan a altas temperaturas. Esto puede ocurrir al soldar acero galvanizado (cubierto de zinc) y puede causar una enfermedad llamada "fiebre por humos de metal". Por esta razón, el acero galvanizado no suele soldarse o se le quita el zinc antes.
Galería de imágenes
Véase también
 En inglés: Zinc oxide Facts for Kids
En inglés: Zinc oxide Facts for Kids