Ácido clórico para niños
Datos para niños
|
||
|---|---|---|
  |
||
 |
||
| Nombre IUPAC | ||
| Ácido trioxoclórico (V) | ||
| General | ||
| Otros nombres | Trioxoclorato (V) de hidrógeno | |
| Fórmula molecular | HClO3 | |
| Identificadores | ||
| Número CAS | 7790-93-4 | |
| Número RTECS | CN9750000 | |
| ChEBI | 17322 | |
| ChEMBL | CHEMBL1161633 | |
| ChemSpider | 18513 | |
| DrugBank | DB14150 | |
| PubChem | 19654 | |
| UNII | Z0V9L75H3K | |
| KEGG | C01485 | |
|
InChI
InChI=InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4)
Key: XTEGARKTQYYJKE-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Solución incolora | |
| Densidad | 1000 kg/m³; 1 g/cm³ | |
| Masa molar | 84.45914 g mol−1 g/mol | |
| Punto de fusión | 253,15 K (−20 °C) | |
| Punto de ebullición | 313,15 K (40 °C) | |
| Propiedades químicas | ||
| Acidez | ca. −1 pKa | |
| Solubilidad en agua | >40 g/100 ml (20 °C), soluble | |
| Peligrosidad | ||
| NFPA 704 |
1
3
2
OX
|
|
| Riesgos | ||
| Riesgos principales | Oxidante | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
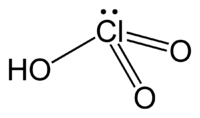
El Ácido clórico, con la fórmula química HClO3, es un tipo de ácido que contiene cloro y oxígeno. Es el punto de partida para crear unas sustancias llamadas cloratos.
Este ácido es muy fuerte y también es un oxidante, lo que significa que puede reaccionar con otras sustancias quitándoles electrones.
Contenido
¿Qué es el Ácido Clórico?
El ácido clórico es un oxácido de cloro. Esto significa que es un compuesto que tiene hidrógeno, oxígeno y cloro. Su fórmula, HClO3, nos dice que cada molécula tiene un átomo de hidrógeno, uno de cloro y tres de oxígeno.
Es conocido por ser un ácido fuerte, lo que indica que se disocia casi por completo en agua, liberando iones de hidrógeno. También es un agente oxidante, lo que le permite participar en reacciones químicas donde "quita" electrones a otras sustancias.
¿Cómo se produce el Ácido Clórico?
El ácido clórico se puede obtener de varias maneras en un laboratorio. Una forma común es mezclando ácido sulfúrico con clorato de bario. En esta reacción, se forma ácido clórico y también sulfato de bario, que es una sustancia que no se disuelve en agua y se separa fácilmente.
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Otra manera de producirlo es calentando ácido hipocloroso. Al hacer esto, se obtiene ácido clórico junto con cloruro de hidrógeno.
- 3HClO → HClO3 + 2 HCl
¿Es estable el Ácido Clórico?
El ácido clórico es más estable cuando está disuelto en agua y se mantiene frío. Puede existir en soluciones de hasta un 30% de concentración. Si se evapora el agua a baja presión, se pueden obtener soluciones un poco más concentradas, hasta un 40%.
Sin embargo, si la concentración es mayor o si se calienta, el ácido clórico se descompone. Esto significa que se rompe en otras sustancias. Por ejemplo, puede formar ácido perclórico, agua, cloro y oxígeno.
Peligros del Ácido Clórico
El ácido clórico es una sustancia que debe manejarse con mucho cuidado debido a sus propiedades. Es importante conocer los posibles efectos si entra en contacto con el cuerpo.
Contacto con la piel o los ojos
Si el ácido clórico toca la piel o las membranas mucosas (como las de la boca o la nariz), puede causar irritación y quemaduras. Esto puede provocar enrojecimiento, dolor y, en casos más serios, daños en los tejidos.
Inhalación de vapores
Respirar los vapores de ácido clórico puede irritar las vías respiratorias. Esto podría causar tos, dificultad para respirar y otros problemas en los pulmones.
Ingestión
Si alguien ingiere ácido clórico, puede afectar el sistema digestivo. Podría causar molestias en la boca, el esófago y el estómago, además de dolor abdominal y náuseas. Por su naturaleza, este ácido no se encuentra en alimentos ni en productos de uso diario.
Medidas de seguridad
Debido a su naturaleza, el ácido clórico se maneja con estrictas medidas de seguridad en entornos industriales. Es fundamental usar equipo de protección adecuado para evitar cualquier contacto.
Véase también
 En inglés: Chloric acid Facts for Kids
En inglés: Chloric acid Facts for Kids


