Sulfito de sodio para niños
Datos para niños
Sulfito de sodio |
||
|---|---|---|
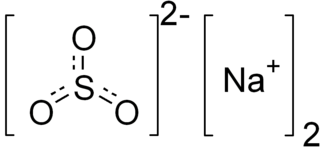 |
||
| Nombre IUPAC | ||
| Sulfito de sodio | ||
| General | ||
| Otros nombres | Sulfito sódico Sulfato (IV) de sodio |
|
| Fórmula estructural |  |
|
| Fórmula molecular | Na2SO3 | |
| Identificadores | ||
| Número CAS | 7757-83-7 | |
| ChEBI | 86477 | |
| ChEMBL | CHEMBL1945334 | |
| ChemSpider | 22845 | |
| PubChem | 20625341, 516934 24437, 20625341, 516934 | |
| UNII | VTK01UQK3G | |
| KEGG | D09002 | |
|
InChI
InChI=InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2
Key: GEHJYWRUCIMESM-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Densidad | 2633 kg/m³; 2,633 g/cm³ | |
| Masa molar | 126,04 g/mol | |
| Punto de fusión | 306,4 K (33 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 27.0 g/100 mL (20 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
|
|
| Compuestos relacionados | ||
| Compuestos relacionados | Hidróxido de sodio Óxido de azufre (IV) Ácido sulfuroso |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfito de sodio (Na2SO3) es un compuesto químico que no tiene color. Se forma cuando el ácido sulfuroso o el óxido de azufre (IV) reaccionan con el hidróxido de sodio. Cuando se disuelve en agua, la solución es un poco básica.
Este compuesto es un poco higroscópico, lo que significa que puede absorber humedad del aire.
Contenido
¿Qué es el Sulfito de Sodio?
El sulfito de sodio, también conocido como sulfito sódico, es una sustancia química importante. Su fórmula es Na2SO3, lo que indica que está compuesto por dos átomos de sodio, uno de azufre y tres de oxígeno.
¿Cómo se forma el Sulfito de Sodio?
El sulfito de sodio se crea a partir de una reacción química. Se combina el ácido sulfuroso o el óxido de azufre (IV) con el hidróxido de sodio. Esta combinación da como resultado el sulfito de sodio y otras sustancias.
Propiedades Químicas del Sulfito de Sodio
El sulfito de sodio tiene algunas propiedades interesantes que lo hacen útil en diferentes campos.
¿Cómo reacciona el Sulfito de Sodio con otras sustancias?
El sulfito de sodio se oxida fácilmente, lo que significa que reacciona con el oxígeno. Cuando esto sucede, se convierte en sulfato de sodio (Na2SO4). Esta propiedad es útil en varias aplicaciones.
Por ejemplo, en un laboratorio, el sulfito de sodio puede usarse para producir óxido de azufre (IV). Esto ocurre cuando reacciona con un ácido, como el ácido sulfúrico.
También puede reaccionar con unas sustancias llamadas aldehídos. Al hacerlo, forma compuestos que no se disuelven fácilmente en líquidos orgánicos. Esta reacción se usa para purificar los aldehídos, ya que se pueden separar y luego recuperar.
Usos y Aplicaciones del Sulfito de Sodio
El sulfito de sodio se utiliza en muchas industrias debido a sus propiedades químicas.
¿Para qué se usa el Sulfito de Sodio en la industria?
- En la industria química: Es un punto de partida para crear otros productos químicos. Por ejemplo, se combina con azufre para producir tiosulfato sódico, que se usa en fotografía.
- Como protector y reductor: Ayuda a proteger tuberías de la corrosión. También se usa para eliminar el cloro que no está unido a otras sustancias.
- En la industria alimentaria: Se usa como conservante y antioxidante para mantener los alimentos frescos. Lo puedes encontrar en las etiquetas como E221. Las cantidades varían, pero en algunos frutos secos puede haber más.
- En otras industrias: Mejora la calidad de productos en la fabricación de caucho y celulosa. También es un paso intermedio para hacer ditionito de sodio.
- Para tratar el agua: En las industrias, se usa para quitar el oxígeno disuelto del agua. Esto es importante para proteger las calderas de vapor y otros tanques de metal, ya que el oxígeno puede dañarlos.
Seguridad y Precauciones con el Sulfito de Sodio
Es importante manejar el sulfito de sodio con cuidado, como cualquier sustancia química.
¿Es seguro el Sulfito de Sodio?
El polvo de sulfito de sodio puede irritar los pulmones si se inhala. Si se ingiere en grandes cantidades, puede ser perjudicial. Algunas personas son más sensibles y pueden sentir dolor de cabeza o náuseas. También podría irritar el sistema digestivo.
Además, la presencia de sulfito de sodio en los alimentos puede reducir la cantidad de algunas vitaminas B y ácido fólico. Por eso, es importante que su uso en alimentos esté regulado.
¿Cómo se obtiene el Sulfito de Sodio en el laboratorio?
En un laboratorio, se puede obtener sulfito de sodio haciendo burbujear óxido de azufre (IV) (un gas) en una solución de hidróxido de sodio o carbonato de sodio.
Véase también
 En inglés: Sodium sulfite Facts for Kids
En inglés: Sodium sulfite Facts for Kids


