Sulfato de plomo(II) para niños
Datos para niños
Sulfato de plomo(II) |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Tetraoxosulfato(VI) de plomo(II) | ||
| General | ||
| Otros nombres | Sulfato de plomo(II) Sulfato plumboso Anglesita, Plomo blanco Freeman. |
|
| Fórmula semidesarrollada | PbSO4 | |
| Fórmula estructural | Pb2+ + 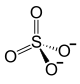 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7446-14-2 | |
| ChemSpider | 22441 | |
| PubChem | 16686003 24008, 16686003 | |
| UNII | C516H654O8 | |
|
InChI
InChI=InChI=1S/H2O4S.Pb/c1-5(2,3)4;/h(H2,1,2,3,4);/q;+2/p-2
Key: KEQXNNJHMWSZHK-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | Sólido cristalino blanco. | |
| Densidad | 6290 kg/m³; 629 g/cm³ | |
| Masa molar | 303,26 g/mol | |
| Punto de fusión | 1443 K (1170 °C) | |
| Estructura cristalina | Ortorrómbico | |
| Propiedades químicas | ||
| Solubilidad en agua | 44 mg/L --- | |
| Producto de solubilidad | 2,53·10-8 --- | |
| Termoquímica | ||
| ΔfH0sólido | -919,97 kJ/mol | |
| S0sólido | 148,5 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | 61-E20/22-33-50/53-62 | |
| Frases S | 53-45-60-61 | |
| Riesgos | ||
| Riesgos principales | es carcinogeno | |
| Ingestión | Corrosivo. Puede dañar severamente las membranas mucosas de la boca, garganta y estómago, provocando la muerte. Puede causar dolor de cabeza, fatiga, náuseas, vómitos y diarrea. Nocivo. | |
| Inhalación | Corrosivo. Produce daños en las mucosas del tracto respiratorio superior, así como irritación de los bronquios y pulmones. | |
| Piel | Corrosivo. Puede provocar enrojecimiento, dolor y quemaduras severas. | |
| Ojos | Corrosivo. Puede causar visión borrosa, enrojecimiento, dolor y quemaduras severas. | |
| LD50 | 30 g/kg (oral conejillo de indias) | |
| Compuestos relacionados | ||
| Otros cationes | Sulfato de estaño(II) Sulfato de hierro(II) Sulfato de cobre(II) Sulfato de potasio |
|
| Otros aniones | Cloruro de plomo(II) Óxido de plomo(II) Nitrato de plomo(II) Oxalato de plomo(II) |
|
| Otros compuestos de Pb y S | Sulfato de plomo(IV) Sulfuro de plomo(II) Sulfito de plomo(II) |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfato de plomo(II) (PbSO4) es un compuesto químico que se presenta como un sólido blanco. Puede ser cristalino o en forma de polvo. También se le conoce como vitriolo de plomo o anglesita.
Aunque el plomo no suele formar muchas sales que se disuelvan en agua, el sulfato de plomo(II) es una de las pocas que sí lo hace, aunque solo un poco.
Este compuesto es común en las baterías de plomo y ácido que se usan en los coches. Cuando una batería se descarga, se forma sulfato de plomo(II) en su interior. Al recargarla, este compuesto se transforma de nuevo en plomo y ácido sulfúrico en una parte de la batería, y en óxido de plomo(IV) y ácido sulfúrico en otra.
Contenido
¿Cómo se obtiene el Sulfato de Plomo(II)?
El sulfato de plomo(II) se puede obtener de varias maneras.
Extracción de Minerales
Una forma es extraerlo directamente de un mineral llamado anglesita. Este mineral tiene la misma composición química, PbSO4. También se puede obtener cuando el mineral galena, que es sulfuro de plomo(II) (PbS), se oxida.
Preparación en Laboratorio
Otra forma de conseguirlo es a partir de la cerusita. Este es un mineral que contiene carbonato de plomo(II) con algunas impurezas. Primero, se trata la cerusita con ácido nítrico para disolver el carbonato de plomo(II). Luego, al añadir ácido sulfúrico, el sulfato de plomo(II) se separa y se puede recoger.
También es posible obtener sulfato de plomo(II) mezclando soluciones de sulfato de sodio y nitrato de plomo.
Propiedades del Sulfato de Plomo(II)
Este compuesto tiene características físicas y químicas interesantes.
Apariencia y Densidad
El sulfato de plomo(II) es un sólido de color blanco. Es bastante denso, lo que significa que una pequeña cantidad pesa mucho. Su densidad es de 6290 kg por m³.
Reacciones Químicas
En soluciones ácidas, el sulfato de plomo(II) no es muy propenso a perder electrones (es decir, no es muy reductor). Sin embargo, en soluciones básicas, sí puede oxidarse. Por ejemplo, puede transformarse en óxido de plomo(IV) en una reacción química.
¿Por qué es importante tener cuidado con el Sulfato de Plomo(II)?
Es muy importante manejar el sulfato de plomo(II) con precaución porque puede ser peligroso.
Este compuesto es corrosivo y puede causar daños si se inhala, se ingiere o entra en contacto con la piel o los ojos. El plomo, que forma parte de este compuesto, puede acumularse en el cuerpo con el tiempo. Incluso pequeñas cantidades pueden ser perjudiciales.
Si entra en contacto con la piel o los ojos, puede causar enrojecimiento, dolor y quemaduras. Si se inhala, puede irritar las vías respiratorias. Si se ingiere, puede causar molestias estomacales y otros problemas.
Además, el sulfato de plomo(II) es muy dañino para los animales y plantas que viven en el agua. Puede tener efectos negativos en el medio ambiente acuático a largo plazo. Por eso, es crucial evitar que llegue a ríos, lagos o mares.
Existe un límite de seguridad para la cantidad de esta sustancia en el aire, que es de 0.15 mg por m³. Si la cantidad es mayor, puede ser perjudicial.
Otros tipos de Sulfatos de Plomo
Además del sulfato de plomo(II) que hemos visto, existen otros compuestos relacionados.
Sales Mixtas
Hay sales que combinan sulfato y óxido de plomo(II) en diferentes proporciones. Estas sales se utilizan en la fabricación de baterías de plomo y ácido. Algunos ejemplos son: PbSO4·PbO, PbSO4·2PbO, PbSO4·3PbO y PbSO4·4PbO.
Minerales Relacionados
También existe un mineral llamado leadhillita o maxita. Es una sal compleja que contiene carbonato, hidróxido y sulfato de plomo(II). Su fórmula es 2PbCO3·PbSO4·Pb(OH)2.
Sulfato Ácido
Cuando la concentración de ácido sulfúrico es muy alta (más del 80%), se puede formar otro tipo de sulfato de plomo(II) llamado sulfato ácido de plomo(II) o hidrógenosulfato de plomo(II), cuya fórmula es Pb(HSO4)2.
Véase también
 En inglés: Lead(II) sulfate Facts for Kids
En inglés: Lead(II) sulfate Facts for Kids
- Sulfato de plomo(IV)

