Reacción química para niños
Una reacción química, también conocida como cambio químico o fenómeno químico, es un proceso donde unas sustancias se transforman en otras completamente diferentes. Imagina que tienes un juego de LEGO: una reacción química es como desarmar tus creaciones y usar las mismas piezas para construir algo totalmente nuevo. Las piezas de LEGO son como los "átomos", y tus creaciones son como las "moléculas".
¿Alguna vez te has preguntado por qué un pastel se vuelve esponjoso en el horno, o por qué una manzana se pone marrón después de cortarla? ¡Todo esto son ejemplos de reacciones químicas! Son cambios que ocurren a nuestro alrededor todo el tiempo, incluso dentro de nosotros.
Contenido
- Los Ingredientes Secretos: Átomos y Moléculas
- ¿Por Qué Ocurren las Reacciones Químicas?
- Los Actores Principales: Reactivos y Productos
- ¿Cómo sabemos que una reacción química está ocurriendo?
- La Ley de Conservación de la Masa: ¡Nada se Pierde!
- Tipos de Reacciones Químicas
- Reacciones Químicas en Nuestra Vida Diaria
- Datos de interés sobre la reacción química
- Véase también
Los Ingredientes Secretos: Átomos y Moléculas
Para entender una reacción química, primero necesitamos conocer a sus protagonistas:
- Átomos: Piensa en los átomos como los bloques de construcción más pequeños de todo lo que existe. Son tan diminutos que no podemos verlos a simple vista, ¡pero están en todas partes! Hay diferentes tipos de átomos, como los de oxígeno, carbono o hidrógeno.
- Moléculas: Cuando dos o más átomos se unen, forman una molécula. Por ejemplo, una molécula de agua (H₂O) está hecha de dos átomos de hidrógeno (H₂) y uno de oxígeno (O). Las moléculas son como pequeñas estructuras hechas de esos bloques de LEGO.
En una reacción química, los átomos no desaparecen ni aparecen de la nada. ¡Solo se reorganizan! Es como si los átomos que estaban unidos de una forma se separaran y volvieran a unirse de una manera diferente, creando nuevas moléculas y, por lo tanto, nuevas sustancias.
¿Por Qué Ocurren las Reacciones Químicas?
Las reacciones químicas ocurren porque las sustancias buscan ser más "estables" o porque hay una fuerza que las impulsa a cambiar, como el calor, la luz o la electricidad. Es como si algunas moléculas no estuvieran muy cómodas con su forma actual y buscaran una nueva configuración que les resultara más "feliz" o "equilibrada".
Los Actores Principales: Reactivos y Productos
En cada reacción química, tenemos dos partes importantes:
- Reactivos: Son las sustancias que tienes al principio, los "ingredientes" que van a reaccionar.
- Productos: Son las sustancias nuevas que se forman después de la reacción, el "resultado" o lo que obtienes al final.
Por ejemplo, cuando quemas un trozo de madera:
Reactivos: La madera y el oxígeno del aire.
Productos: Cenizas, humo (gases como dióxido de carbono) y calor/luz.
¿Cómo sabemos que una reacción química está ocurriendo?
¡Hay varias pistas que podemos observar!
- Cambio de color: Una manzana que se oxida y se pone marrón.
- Formación de burbujas (gas): Cuando mezclas bicarbonato de sodio con vinagre y ves que burbujea.
- Cambio de temperatura: Algunas reacciones liberan calor (se ponen calientes, como quemar algo) y otras absorben calor (se ponen frías, como algunas compresas frías instantáneas).
- Formación de un sólido (precipitado): A veces, al mezclar dos líquidos transparentes, aparece una sustancia sólida que se asienta en el fondo.
- Producción de luz: Como cuando enciendes un fósforo o ves fuegos artificiales.
- Cambio de olor: Cuando la comida se echa a perder, su olor cambia debido a reacciones químicas.
La Ley de Conservación de la Masa: ¡Nada se Pierde!
Un dato muy importante sobre las reacciones químicas es la Ley de Conservación de la Masa. Esta ley nos dice que, en una reacción química, la cantidad total de materia (la masa) que tienes al principio (en los reactivos) es exactamente la misma que la cantidad total de materia que tienes al final (en los productos). ¡Los átomos solo se reorganizan, no se crean ni se destruyen! Es como si desarmaras tu castillo de LEGO y construyeras un cohete: sigues teniendo el mismo número de piezas de LEGO.
Tipos de Reacciones Químicas
Hay muchos tipos de reacciones, pero aquí te presentamos algunas de las más básicas:
Reacciones de Combinación (o Síntesis)
Imagina que tienes dos amigos (A y B) que se unen para formar un nuevo equipo (AB). En química, dos o más sustancias simples se unen para formar una sustancia más compleja.
Ejemplo: El hierro (Fe) se combina con el oxígeno (O₂) para formar óxido de hierro (Fe₂O₃), ¡que es el óxido que ves en los metales!
Reacciones de Descomposición
Es lo contrario a la combinación. Un equipo (AB) se separa en sus miembros originales (A y B). Una sustancia compleja se rompe en dos o más sustancias más simples.
Ejemplo: Cuando calientas agua oxigenada (peróxido de hidrógeno, H₂O₂), se descompone en agua (H₂O) y oxígeno (O₂).
Reacciones de Combustión
Son reacciones rápidas que producen calor y luz, ¡como el fuego! Siempre involucran oxígeno.
Ejemplo: Cuando quemas una vela, la cera (un combustible) reacciona con el oxígeno del aire para producir dióxido de carbono, agua, calor y luz.
Reacciones Químicas en Nuestra Vida Diaria
¡Las reacciones químicas no solo ocurren en los laboratorios! Las vemos y las vivimos todos los días:
- Cocinar y Hornear: Cuando horneas un pastel, el calor hace que los ingredientes (harina, huevos, azúcar, levadura) reaccionen. La levadura produce burbujas de gas que hacen que el pastel suba y se vuelva esponjoso. Al freír un huevo, las proteínas del huevo cambian su estructura debido al calor, pasando de ser transparentes y líquidas a blancas y sólidas.
- La Digestión de Alimentos: Dentro de tu cuerpo, tu sistema digestivo usa reacciones químicas para descomponer la comida en nutrientes más pequeños que tu cuerpo puede usar para obtener energía y crecer. ¡Es como una fábrica química interna!
- La Fotosíntesis: ¡Las plantas son increíbles químicas! Usan la luz del sol, el dióxido de carbono del aire y el agua para realizar una reacción química llamada fotosíntesis. Con ella, producen su propio alimento (azúcares) y liberan oxígeno, ¡que es lo que respiramos!
- El Óxido: Cuando dejas un objeto de metal (como un clavo de hierro) al aire libre y se moja, el hierro reacciona lentamente con el oxígeno y el agua para formar óxido, una sustancia de color rojizo-marrón.
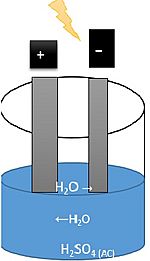
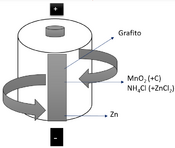
- Las Baterías: Las baterías que usas en tus juguetes o controles remotos funcionan gracias a reacciones químicas que producen electricidad.
- Limpieza: Muchos productos de limpieza funcionan gracias a reacciones químicas que disuelven la grasa o la suciedad.
Datos de interés sobre la reacción química
- Las reacciones ocurren porque las moléculas están en constante movimiento. Cuando chocan con suficiente energía, los enlaces químicos se rompen. Los átomos se intercambian para formar nuevas moléculas.
- Generalmente, al aumentar la temperatura, las moléculas se mueven más rápido. Esto provoca más colisiones y con mayor energía. El aumento de temperatura incrementa el número de colisiones exitosas.
- La forma en que representamos una reacción química con símbolos se llama ecuación química.
- En una reacción química hay cosas que siempre se mantienen iguales, como el número de cada tipo de átomo, la carga eléctrica y la masa total.
- Un catalizador es una sustancia que acelera una reacción. El catalizador no se consume en la reacción.
- En reacciones que involucran sólidos, aumentar la superficie de contacto acelera la reacción. Esto se debe a que más partículas del sólido están expuestas para reaccionar.
Véase también
 En inglés: Chemical reaction Facts for Kids
En inglés: Chemical reaction Facts for Kids