Prion para niños
Un prion es un tipo especial de proteína que no está bien doblada. Imagina que las proteínas son como piezas de origami; un prion es una pieza que se dobló de forma incorrecta. Lo más sorprendente es que esta proteína mal doblada puede hacer que otras proteínas normales de su mismo tipo también se doblen mal.
Los priones son los causantes de un grupo de enfermedades que afectan el cerebro y los nervios, llamadas encefalopatías espongiformes transmisibles. Algunas de estas enfermedades son la tembladera en animales, la enfermedad de Creutzfeldt-Jakob y el insomnio familiar fatal en humanos, y la encefalopatía espongiforme bovina (conocida como la enfermedad de las "vacas locas"). Los priones son considerados agentes que pueden causar enfermedades, pero a diferencia de los virus o las bacterias, no tienen ácido nucleico (como el ADN o el ARN).
La proteína priónica normal se abrevia como PrPc y se encuentra de forma natural en muchas células de nuestro cuerpo. Sin embargo, puede transformarse en una forma que causa daño, llamada PrPSc, cuando su estructura se altera y se dobla de manera incorrecta. A diferencia de otros agentes que causan enfermedades (como hongos, bacterias o virus), que tienen ácidos nucleicos, un prion solo está hecho de aminoácidos y no tiene material genético. Los priones se originan de un error en la forma en que se fabrica la proteína a partir de un gen llamado PRNP. Aunque es extraño para algo que causa enfermedades, las enfermedades por priones a veces se consideran un tipo de enfermedad genética.
La palabra "prion" fue creada en 1982 por Stanley B. Prusiner. Él estaba investigando enfermedades que afectaban el sistema nervioso central de forma crónica e irreversible. La palabra "prion" viene de las palabras "proteína" e "infección" en inglés. Estas proteínas mutadas forman grupos grandes y son dañinas, con formas anómalas ricas en láminas beta que pueden reproducirse a sí mismas.
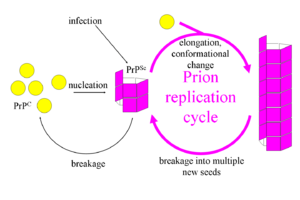
Los priones se multiplican transmitiendo su forma mal doblada a otras proteínas normales. Cuando un prion entra en un organismo sano, actúa sobre las proteínas normales del mismo tipo que ya existen en ese organismo. Las modifica y las convierte en priones también. Estos nuevos priones pueden seguir convirtiendo más proteínas, creando una reacción en cadena que produce muchas proteínas priónicas. Todos los priones conocidos hacen que se formen estructuras llamadas amiloides, que son como fibras apretadas. El tiempo que tarda en aparecer una enfermedad priónica depende de qué tan rápido se multiplican los priones.
Contenido
- ¿Qué hacen los priones cuando no causan enfermedades? (PrPc)
- Historia de los priones
- Tipos de priones
- Características de los priones
- Cómo se contagia la estructura dañina y se forman las placas
- Cómo se transmite la enfermedad
- Viaje hacia el cerebro
- Enfermedades causadas por priones
- Los priones en la vida normal de los organismos
- Experimentos en el laboratorio
- Cómo se detecta la PrPSc
- Posibles tratamientos preventivos
- Véase también
¿Qué hacen los priones cuando no causan enfermedades? (PrPc)
Aunque todavía no se sabe mucho sobre la función exacta de la proteína PrPc (la forma normal que no causa enfermedades), algunos estudios han mostrado que es importante para el desarrollo correcto de las neuronas. También se ha visto que puede unirse a un elemento llamado cobre (Cu2+) y que está relacionada con procesos de comunicación entre células, la unión de las células entre sí y la forma en que se regulan ciertos receptores en el cuerpo.
Historia de los priones
Las primeras descripciones de enfermedades causadas por priones se remontan al siglo XVIII, cuando ganaderos en Europa notaron una enfermedad que dañaba el cerebro y era mortal en ovejas y cabras. A esta enfermedad la llamaron "tembladera". El cerebro de los animales afectados se veía como una esponja, de ahí el término "espongiforme".
A principios del siglo XX, se describieron los primeros casos de una enfermedad similar en humanos, que se llamó enfermedad de Creutzfeldt-Jakob. Más tarde se demostró que estas enfermedades podían transmitirse. El agente que las causaba, el prion, fue descubierto en 1982 por Stanley B. Prusiner. Él demostró que eran partículas hechas solo de proteínas y que no tenían ácido nucleico. Por este descubrimiento, recibió el Premio Nobel de Fisiología o Medicina en 1997.
Prusiner realizó experimentos para ver cómo los priones perdían su capacidad de causar enfermedades. Observó que si los trataba con ciertas sustancias que alteran las proteínas, perdían su capacidad de infección. Sin embargo, si los trataba con sustancias que atacan los ácidos nucleicos (como el ADN o el ARN), o con radiación ultravioleta, los priones no perdían su capacidad de infección. Esto demostró que los priones eran partículas dañinas hechas de proteínas y sin ácido nucleico. Más tarde, Prusiner logró infectar ratones con el prion de la tembladera, lo que permitió estudiar los priones con más detalle.
Tipos de priones
Se han encontrado priones en mamíferos y en levaduras. Los priones de levaduras no suelen causar enfermedades. Algunos de los priones conocidos son:
- Priones de mamíferos:
- Prion de la tembladera (Scrapie prion)
- Prion de la encefalopatía transmisible del visón (TME prion)
- Prion de la enfermedad crónica de desgaste (CWD prion)
- Prion de la encefalopatía espongiforme bovina (BSE prion)
- Prion de la encefalopatía espongiforme felina (FSE prion)
- Prion de la encefalopatía espongiforme del ungulado exótico (EUE prion)
- Prion del Kuru
- Prion de la enfermedad de Creutzfeldt-Jakob (CJD prion)
- Prion de la nueva variante de la enfermedad de Creutzfeldt-Jakob (vCJD prion)
- Prion de la enfermedad de Gerstmann-Straüssler-Scheinker (GSS prion)
- Prion del insomnio familiar fatal (FFI prion)
- Priones de levaduras:
- URE3 prion
- PSI prion
- Het-s prion
- PIN prion
- β prion
- SWI prion
- OCT prion
- MOT3 prion
- ISP prion
- GAR+ prion
- MOD+ prion
Características de los priones
Una vez que se identificó el prion que causaba las enfermedades, se empezó a estudiar su estructura. Es una glicoproteína que tiene la misma estructura básica que una proteína similar que se encuentra en el cerebro de las ovejas. El cambio en su forma no es genético, sino que ocurre después de que la proteína se ha fabricado.
El gen que produce la proteína priónica normal (PrPc), llamado PRNP, se encuentra en el cromosoma 20. Este gen se activa en tejidos como el cerebro, el corazón, los músculos, el páncreas y el hígado.
Cuando la proteína PrPc se dobla mal y se convierte en PrPSc, adquiere dos propiedades diferentes: se vuelve parcialmente resistente a ser descompuesta por ciertas enzimas y se vuelve insoluble. Estas propiedades hacen que la PrPSc sea muy estable y pueda formar grupos de proteínas que se acumulan en el tejido nervioso, creando placas que dañan las neuronas.
Las principales diferencias entre la forma normal del prion (PrPc) y la forma que causa enfermedades (PrPSc) son:
| PrPc | PrPSc |
|---|---|
| Estructura en forma de hélice α (como un muelle) | Estructura en forma de lámina β (más plana) |
| Puede ser descompuesta por proteasas | Resistente a las proteasas |
| Proteína individual | Forma grupos de proteínas |
| Unidades individuales estables | Unidades individuales poco estables (forman grupos dañinos) |
| Resistencia normal | Muy resistente a la radiación y a sustancias fuertes |
| Se disuelve en detergentes | No se disuelve en detergentes |
Es importante recordar que tanto la PrPc como la PrPSc tienen la misma secuencia de aminoácidos, ya que provienen del mismo gen.
Cómo se contagia la estructura dañina y se forman las placas
Cuando una proteína normal (PrPc) en una membrana celular del cerebro entra en contacto con una proteína PrPSc (la que causa daño), la PrPSc actúa como un agente que la "infecta". Esto hace que la PrPc cambie su forma de hélice a una estructura plana de lámina beta, convirtiéndose también en PrPSc.
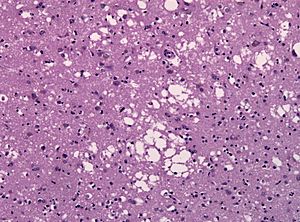
Debido a este cambio de forma, la nueva proteína PrPSc no puede ser descompuesta y sigue "infectando" a otras PrPc, haciendo que se doblen mal de forma muy rápida. Esto provoca que se acumulen grandes grupos de PrPSc en forma de placas, que son como fibras insolubles. Estas placas matan las neuronas y dejan agujeros en el cerebro, dándole un aspecto esponjoso.
Cómo se transmite la enfermedad
No se sabe exactamente cómo la PrPc se convierte en PrPSc. Una de las ideas es que se forman ciertos enlaces químicos que cambian la forma de la proteína. Otra idea es que la sustitución de un aminoácido llamado leucina por prolina podría desestabilizar la forma de hélice de la proteína y transformarla en la forma dañina.
Viaje hacia el cerebro
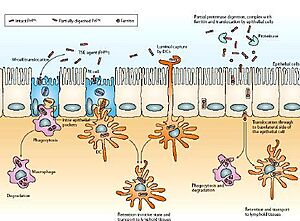
Si una persona o animal come algo contaminado con priones, el agente dañino es transportado por el intestino. Desde allí, entra en unas células especiales que lo llevan a otras células del sistema inmunitario. Aunque el cuerpo intenta crear defensas contra el prion, estas no son efectivas. Por eso, el prion es transportado por el sistema inmunitario y se acumula en órganos como el bazo y los ganglios linfáticos, que están conectados con los nervios. Esto permite que el prion llegue al tejido nervioso y cause la muerte de las neuronas, haciendo que el cerebro se vea esponjoso.
La muerte de las neuronas ocurre porque las PrPSc son insolubles y resistentes a las enzimas que las deberían descomponer. Esto hace que las PrPSc se acumulen dentro de las células, haciendo que estas se hinchen y finalmente mueran.
Enfermedades causadas por priones
Existen tres formas en que se presentan las enfermedades por priones:
- Esporádicas: Aparecen sin una causa clara y no tienen una explicación científica conocida.
- Infecciosas: Son el resultado de la interacción de la PrPSc con la PrPc, lo que provoca su transformación.
- Hereditarias: Son causadas por cambios genéticos que facilitan que la PrPc se doble mal.
En los animales

En los animales, las enfermedades por priones causan problemas de coordinación, ceguera o la muerte. Las más conocidas son:
- La Encefalopatía espongiforme bovina (conocida como la enfermedad de las vacas locas), que se detectó por primera vez en 1984. Se cree que fue causada por alimentar al ganado con restos de ovejas y cabras que ya tenían la enfermedad.
- La tembladera en ovejas y cabras, que no se transmite directamente a los humanos, pero sí puede pasar a las vacas, y estas sí pueden transmitirla a los humanos.
- También se han registrado algunos casos en felinos.
En los seres humanos
En los humanos, la susceptibilidad a las enfermedades por priones puede depender de ciertas características genéticas.
- Enfermedad de Creutzfeldt-Jakob (ECJ): Es la forma más común. Generalmente aparece de forma esporádica (sin causa aparente) en personas de 50 a 60 años. Un pequeño porcentaje de casos son de origen infeccioso, por ejemplo, por transfusiones de sangre o, en el pasado, por el uso de hormonas o tejidos de cadáveres humanos infectados. Entre el 10% y el 15% de los casos son de origen genético. La muerte suele ocurrir entre 4 y 6 meses después del diagnóstico.
- Insomnio familiar fatal: Es un trastorno del sueño que suele ser de origen genético, causado por un cambio específico en el gen del prion. Se conocen pocos casos.
- Nueva variante de la enfermedad de Creutzfeldt-Jakob: Se transmitió y apareció en Gran Bretaña en los años 90. Se ha relacionado con el consumo de productos de reses afectadas por la encefalopatía espongiforme bovina. Afecta a personas más jóvenes (edad promedio de 27 años) y la enfermedad dura unos 14 meses antes de causar la muerte.
- Enfermedad de Gerstmann-Straüssler-Scheinker: Es de origen genético.
- Kuru: Se transmitió y estaba limitada a poblaciones de Papúa Nueva Guinea. Se relacionaba con prácticas de canibalismo ritual (consumo de cerebros humanos infectados). Se considera una enfermedad en extinción. Puede tener un periodo de incubación muy largo, de 4 a 40 años.
Por estas enfermedades, a los priones a veces se les llama "proteínas zombis".
En microorganismos
Algunos microorganismos, como la levadura de cerveza (Saccharomyces cerevisiae), también pueden ser afectados por priones.
Los priones en la vida normal de los organismos
Las investigaciones sobre los priones han permitido observar que existen proteínas similares a los priones en organismos sanos, sin que estén relacionadas con una enfermedad. En hongos, como Saccharomyces cerevisiae, se ha visto que los priones pueden tener funciones importantes, como regular el metabolismo del nitrógeno. También pueden influir en la forma en que se heredan ciertas características y aumentar la diversidad genética.
En 2003, E. R. Kandel y su equipo identificaron una proteína parecida a un prion en un tipo de caracol marino llamado Aplysia. Esta proteína está relacionada con procesos de memoria y aprendizaje. La capacidad de los priones para guardar información sobre su forma los hace candidatos para participar en procesos celulares que necesitan estabilidad a largo plazo, como la formación de la memoria a largo plazo y la memoria inmunitaria.
Experimentos en el laboratorio
Se han realizado varios experimentos en el laboratorio, principalmente con ratones a los que se les ha modificado el gen PRNP (que produce la proteína priónica normal). Se ha observado que los ratones sin este gen se desarrollan de forma normal, aunque algunos pueden mostrar problemas de coordinación o alteraciones del ritmo cardíaco después de los dos años de edad. En estos ratones, se ha visto una disminución del tamaño del cerebelo (parte del cerebro encargada de la coordinación) y deficiencias neuronales a largo plazo. Sin embargo, no desarrollan la enfermedad, ya que no tienen la proteína PrPc que los priones puedan infectar.
Cómo se detecta la PrPSc
La presencia de la PrPSc (la forma dañina del prion) se puede detectar usando técnicas de laboratorio como la electroforesis. La PrPSc es resistente a una enzima llamada proteasa K, a diferencia de la PrPc, que no lo es. Esta diferencia permite identificarlas.
Posibles tratamientos preventivos
Un posible tratamiento para detener la acción de la PrPSc podría ser usar medicamentos que estabilicen la forma normal de la proteína (PrPc) y así eviten que se convierta en la forma dañina.
Otra idea es que, dado que los animales sin el gen PRNP se desarrollan de forma normal, se podría intentar eliminar este gen del cerebro de las personas enfermas o crear medicamentos que impidan que el gen se active. Esto se debe a que los priones necesitan la presencia de la PrPc para poder multiplicarse.
También se podría usar medicamentos que impidan que la PrPc y la PrPSc interactúen, o cualquier sustancia que interfiera con los procesos celulares que manejan y descomponen las proteínas, especialmente la PrPc.
Véase también
 En inglés: Prion Facts for Kids
En inglés: Prion Facts for Kids