Hexafluoruro de azufre para niños
Datos para niños
Hexafluoruro de azufre |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Hexafluoruro de azufre | ||
| General | ||
| Otros nombres | Elagas™, Esaflon™ | |
| Fórmula semidesarrollada | SF6 | |
| Fórmula estructural | 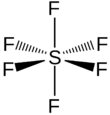 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 2551-62-4 | |
| Número RTECS | WS4900000 | |
| ChEBI | 30496 | |
| ChEMBL | CHEMBL1796998 | |
| ChemSpider | 16425 | |
| DrugBank | DB11104 | |
| PubChem | 17358 | |
| UNII | WS7LR3I1D6 | |
| KEGG | D05962 | |
|
InChI
InChI=InChI=1S/F6S/c1-7(2,3,4,5)6
Key: SFZCNBIFKDRMGX-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 6,164 g/l (gas, 20 °C, 1 atm) kg/m³; 1,371 g/ml (líquido, 21 °C) g/cm³ | |
| Masa molar | 146 g/mol | |
| Punto de ebullición | 209 K (−64 °C) | |
| Punto de descomposición | 773 K (500 °C) | |
| Temperatura crítica | 318,5 K (45 °C) | |
| Presión crítica | 37,1 atm | |
| Estructura cristalina | sistema cristalino ortorrómbico | |
| Propiedades químicas | ||
| Solubilidad en agua | muy baja | |
| Momento dipolar | 0 D | |
| Peligrosidad | ||
| NFPA 704 |
|
|
| Riesgos | ||
| Riesgos principales | No inflamable, no tóxico | |
| Ingestión | imposible | |
| Inhalación | En concentraciones elevadas (más del 80 %), narcosis. Mayores concentraciones pueden producir asfixia por desplazamiento de oxígeno. | |
| Piel | no hay riesgo | |
| Ojos | no hay riesgo | |
| LD50 | 5790 mg/kg (en ratas) | |
| Más información | Gas muy pesado. Peligro de asfixia por fugas de gas en sótanos o lugares poco ventilados. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El hexafluoruro de azufre (SF6) es un compuesto inorgánico especial. A temperatura y presión normales, es un gas que no tiene color ni olor. Además, no es tóxico ni inflamable.
Una de sus características más curiosas es que es mucho más pesado que el aire, ¡aproximadamente cinco veces más! Esto significa que tiene una densidad de 6,13 gramos por litro a una atmósfera de presión.
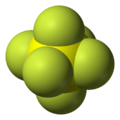
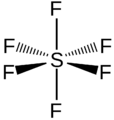
La molécula de SF6 tiene una forma llamada geometría molecular octaédrica. Esto significa que un átomo central de azufre está unido a seis átomos de flúor, formando una figura con ocho caras triangulares. Es un gas muy estable y no reacciona fácilmente con otras sustancias. Es poco soluble en agua, pero sí se disuelve en algunos disolventes orgánicos.
Este gas contribuye al efecto invernadero, que es el calentamiento de la Tierra. Aunque es muy potente (unas 20.000 veces más que el CO2), su alta densidad hace que no suba a las capas más altas de la atmósfera. Sin embargo, dura mucho tiempo en el ambiente (unos 3.200 años), por lo que su impacto en el calentamiento global es importante.
Contenido
¿Cómo se obtiene el hexafluoruro de azufre?
El hexafluoruro de azufre fue descubierto en 1901 por los científicos Henri Moissan y Paul Lebeau. Ellos lo crearon al combinar azufre (S8) con flúor gaseoso (F2) a una temperatura de 300 grados Celsius.
Hoy en día, se sigue usando un método similar para producirlo a gran escala. Después de la reacción, el gas pasa por procesos de purificación para asegurar que sea de alta calidad.
Usos y propiedades del SF6
El hexafluoruro de azufre tiene una propiedad muy útil: es un excelente aislante eléctrico. Esto significa que no permite que la electricidad pase a través de él fácilmente. Por esta razón, se utiliza mucho en los sistemas de distribución de electricidad, especialmente en equipos de alto voltaje.
También se usa en algunas industrias, como la metalúrgica, y en ciertos procedimientos médicos, como la cirugía ocular.
¿Es peligroso el hexafluoruro de azufre?
A temperaturas muy altas (más de 204 grados Celsius), el hexafluoruro de azufre puede descomponerse. Cuando esto ocurre, forma otras sustancias que sí pueden ser perjudiciales, como el ácido fluorhídrico y el dióxido de azufre.
Es importante manejarlo con cuidado, especialmente en lugares cerrados. Debido a que es mucho más pesado que el aire, si hay una fuga en un sótano o un lugar poco ventilado, el gas puede acumularse en el suelo y desplazar el oxígeno, lo que podría causar asfixia.
Datos curiosos sobre el hexafluoruro de azufre
Este gas es conocido por un efecto muy divertido en la voz humana. Si alguien inhala una pequeña cantidad (¡siempre bajo supervisión y con precaución!), la voz suena mucho más grave. Esto es lo contrario de lo que ocurre con el helio, que hace la voz más aguda. La densidad del hexafluoruro de azufre hace que las cuerdas vocales vibren más lento.
Otra curiosidad es que, debido a su alta densidad, puedes hacer que objetos ligeros "floten" sobre él. Si llenas un recipiente con hexafluoruro de azufre, puedes colocar un objeto pequeño y ligero, como un barco de papel, y parecerá que flota en el aire.
Galería de imágenes
Véase también
 En inglés: Sulfur hexafluoride Facts for Kids
En inglés: Sulfur hexafluoride Facts for Kids