Fenol para niños
Datos para niños
Fenol |
||
|---|---|---|
 Muestra de fenol. Peligros y riesgos.
|
||
 Estructura química del fenol
|
||
| General | ||
| Fórmula semidesarrollada | C6H5OH o φOH | |
| Fórmula estructural | Ver imagen. | |
| Fórmula molecular | C6H6O | |
| Identificadores | ||
| Número CAS | 108-95-2 | |
| Número RTECS | SJ3325000 | |
| ChEBI | 15882 | |
| ChEMBL | CHEMBL14060 | |
| ChemSpider | 971 | |
| DrugBank | DB03255 | |
| PubChem | 20488062 996, 20488062 | |
| UNII | 339NCG44TV | |
| KEGG | C00146 D00033, C00146 | |
|
InChI
InChI=InChI=1S/C6H6O/c7-6-4-2-1-3-5-6/h1-5,7H
Key: ISWSIDIOOBJBQZ-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Blanco-incoloro | |
| Densidad | 1070 kg/m³; 1,07 g/cm³ | |
| Masa molar | 94,11 g/mol | |
| Punto de fusión | 40,5 °C (314 K) | |
| Punto de ebullición | 181,7 °C (455 K) | |
| Propiedades químicas | ||
| Acidez | 9,88 pKa | |
| Solubilidad en agua | 8,3 g/100 ml (20 °C) | |
| Momento dipolar | 1,7 D | |
| Peligrosidad | ||
| SGA |    |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El fenol es un compuesto químico que, en su forma pura, es un sólido cristalino de color blanco o incoloro. Se le conoce también con otros nombres como ácido carbólico o hidroxibenceno. Su fórmula química es C6H6O.
Este compuesto se derrite a 43 grados Celsius y hierve a 182 grados Celsius. El fenol se usa para crear muchos productos importantes. Por ejemplo, se utiliza para fabricar plásticos, detergentes, herbicidas y varios fármacos.
Originalmente, el fenol se obtenía del alquitrán de hulla. Hoy en día, se produce en grandes cantidades a partir de materiales que vienen del petróleo. Es un material muy importante en la industria química.
Contenido
Descubrimiento e historia del fenol
El fenol fue descubierto en 1834 por un científico llamado Friedrich Ferdinand Runge. Él lo encontró en el alquitrán de hulla, que era la principal fuente de fenol en ese tiempo.
Más tarde, en 1841, el químico francés Auguste Laurent logró obtener fenol en su forma pura. En 1843, otro químico francés, Charles Frédéric Gerhardt, le dio el nombre de "phénol".
El fenol en la medicina
El fenol fue muy importante en la historia de la medicina. El cirujano Joseph Lister (1827-1912) usó las propiedades del fenol para limpiar heridas durante las cirugías. Él notó que si las heridas se limpiaban bien con ácido carbólico (fenol), se reducían las infecciones.
Lister cubría las heridas con paños empapados en fenol. Aunque el fenol irritaba la piel, su uso ayudó a que menos pacientes murieran después de las operaciones. Esto llevó a desarrollar técnicas de cirugía más limpias, conocidas como técnicas asépticas.
Un ejemplo famoso fue en 1865, cuando Lister trató a un niño con una fractura grave en la pierna. Gracias al fenol, el niño se recuperó sin necesidad de amputación, algo que era muy común en esa época para este tipo de lesiones.
Las ideas de Lister cambiaron la cirugía. Antes de que se usaran estas técnicas, casi la mitad de los pacientes morían después de una operación. Con el fenol, la tasa de mortalidad bajó mucho, lo que fue un gran avance.
Propiedades del fenol
El fenol es un compuesto que se disuelve en agua, aunque no en grandes cantidades. Por ejemplo, 84.2 gramos de fenol se disuelven en 1000 mililitros de agua a 20 grados Celsius.
Es un sólido que puede quemarse. Cuando se calienta, el fenol produce vapores que pueden ser explosivos si se mezclan con el aire en ciertas concentraciones. Por eso, es importante tener cuidado con él.
¿Es el fenol un ácido?
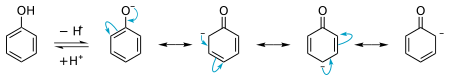
El fenol es un ácido débil. Esto significa que, cuando se disuelve en agua, libera una pequeña cantidad de iones de hidrógeno. Es más ácido que otros tipos de alcoholes.
La razón de su acidez se debe a cómo se organizan sus átomos, lo que hace que sea más fácil para el fenol liberar esos iones de hidrógeno.
Usos del fenol
El fenol se utiliza principalmente para fabricar resinas fenólicas, que son un tipo de plástico. También es un componente clave en la producción de nailon y otras fibras sintéticas.
En la industria química y farmacéutica, el fenol es un desinfectante potente. Se usa como fungicida (para eliminar hongos) y bactericida (para eliminar bacterias). También se emplea para producir agroquímicos, bisfenol A (que se usa en resinas y policarbonatos), y en la fabricación de ácido acetilsalicílico (la aspirina).
Además, el fenol se encuentra en algunos productos médicos como enjuagues bucales y pastillas para el dolor de garganta.
Usos médicos específicos
Aunque el fenol ya no se usa como antiséptico general en cirugía debido a que irrita la piel, todavía tiene algunos usos médicos específicos. Por ejemplo, se utiliza para cauterizar (quemar) tejidos en ciertos procedimientos, como en el tratamiento de uñas encarnadas.
Riesgos del fenol
El fenol se evapora más lentamente que el agua. Tiene un olor y sabor que se pueden detectar incluso en cantidades pequeñas. Es importante saber que el fenol es corrosivo, lo que significa que puede dañar la piel y otros materiales. Sus vapores son inflamables y pueden ser explosivos si entran en contacto con fuego.
Si se ingiere en grandes cantidades, el fenol puede ser muy peligroso. Puede causar envenenamiento, vómitos, cambios en el color de la piel e irritación en las vías respiratorias.
Lamentablemente, el fenol es un desecho común de algunas industrias, como las que trabajan con carbón y petróleo. Cuando el fenol llega a fuentes de agua y se mezcla con cloro (que se usa para tratar el agua), puede formar otros compuestos que son dañinos para los seres vivos.
Biodegradación del fenol
Algunos tipos de bacterias pueden ayudar a eliminar el fenol del ambiente. Por ejemplo, la bacteria Cryptanaerobacter phenolicus puede transformar el fenol en otra sustancia llamada benzoato. Otra bacteria, Rhodococcus phenolicus, es capaz de usar el fenol como su única fuente de alimento, ayudando a descomponerlo.
Véase también
 En inglés: Phenol Facts for Kids
En inglés: Phenol Facts for Kids
- Fenoles (metabolitos secundarios de las plantas)