Éter etílico para niños
Datos para niños
Éter etílico |
||
|---|---|---|
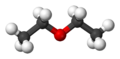
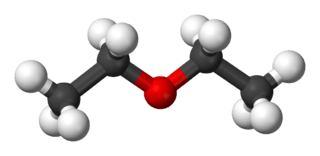 Estructura tridimensional
|
||
 |
||
| Nombre IUPAC | ||
| Etoxietano | ||
| General | ||
| Otros nombres | Dietiléter Éter etílico Éter sulfúrico |
|
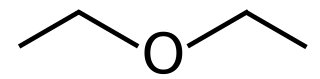
| Fórmula semidesarrollada | CH3-CH2-O-CH2-CH3 | |
| Fórmula estructural | ||
| Fórmula molecular | C4H10O | |
| Identificadores | ||
| Número CAS | 60-29-7 | |
| Número RTECS | KI5775000 | |
| ChEBI | 35702 | |
| ChEMBL | CHEMBL16264 | |
| ChemSpider | 3168 | |
| DrugBank | DB13598 | |
| PubChem | 3283 | |
| UNII | 0F5N573A2Y | |
| KEGG | D01772 | |
|
InChI
InChI=InChI=1S/C4H10O/c1-3-5-4-2/h3-4H2,1-2H3
Key: RTZKZFJDLAIYFH-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 713,4 kg/m³; 0,7134 g/cm³ | |
| Masa molar | 74,12 g/mol | |
| Punto de fusión | −116,3 °C (157 K) | |
| Punto de ebullición | 34,6 °C (308 K) | |
| Presión de vapor | 440 mmHg (20 °C) | |
| Viscosidad | 0,224 cP | |
| Índice de refracción (nD) | 1,353 | |
| Propiedades químicas | ||
| Solubilidad en agua | 6,9 g/100 ml (20 °C) | |
| Momento dipolar | 1,15 D | |
| Termoquímica | ||
| ΔfH0líquido | -271,2 kJ/mol | |
| S0líquido, 1 bar | 253,5 J·mol–1·K–1 | |
| Capacidad calorífica (C) | 172,5 J/mol·K | |
| Peligrosidad | ||
| Punto de inflamabilidad | 228 K (−45 °C) | |
| NFPA 704 |
4
2
1
|
|
| Temperatura de autoignición | 433 K (160 °C) | |
| Límites de explosividad | 1,9-48,0 % | |
| Riesgos | ||
| Riesgos principales | Causa síntomas de adormecimiento y anestesia y, en casos extremos, puede detener la respiración | |
| Inhalación | Causa náuseas, vómito, dolor de cabeza y pérdida de la conciencia, irritación del tracto respiratorio | |
| Piel | Produce resequedad y dermatitis | |
| Ojos | Irritación leve y severa | |
| Compuestos relacionados | ||
| Éteres relacionados | Dimetiléter Dibutil éter |
|
| Otros compuestos relacionados | Etanol Ácido sulfúrico |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El etoxietano, también conocido como éter etílico o dietiléter, es un éter líquido. Es incoloro, muy inflamable y tiene un punto de ebullición bajo. Su sabor es fuerte y un poco picante.
Este líquido es menos denso que el agua, con una densidad de 736 kg/m³. Sin embargo, su vapor es más denso que el aire, pesando 2,56 kg/m³. El éter etílico se convierte en vapor con el calor del cuerpo (a 34,5 °C) y se vuelve sólido a -116 °C.
Contenido
Éter Etílico: Un Compuesto Químico Interesante
¿Qué es el Éter Etílico?
El éter etílico es un tipo de compuesto químico. Se usa mucho porque puede disolver bien otras sustancias. Por ejemplo, disuelve grasas, azufre y fósforo.
Propiedades y Usos del Éter Etílico
¿Cómo se usa en la industria?
El éter etílico se utiliza como disolvente en varias industrias. Es importante en la fabricación de explosivos. También se usa en la industria alimenticia para producir aceites comestibles. Después de usarlo, se separa del aceite mediante un proceso llamado destilación.
La Historia del Éter Etílico
¿Quién lo descubrió y le dio nombre?
Se cree que el alquimista Ramon Llull pudo haber descubierto el éter etílico en 1275. Sin embargo, no hay pruebas claras de esto. La primera vez que se sintetizó (se creó en un laboratorio) fue en 1540 por Valerius Cordus. Él lo llamó "aceite dulce de vitriolo". Este nombre se debe a que se obtuvo al mezclar etanol y ácido sulfúrico. El ácido sulfúrico era conocido antes como "aceite de vitriolo".
Casi al mismo tiempo, Theophrastus Bombastus von Hohenheim, conocido como Paracelso, descubrió que el éter podía aliviar el dolor. El nombre "éter" se lo dio August Sigmund Frobenius en 1730.
El Éter Etílico en la Medicina
¿Cómo se usó como anestésico?
El médico estadounidense Crawford Williamson Long fue el primero en usar el éter etílico como anestésico general en una cirugía. Esto ocurrió el 30 de marzo de 1842. Sin embargo, otros, como los dentistas Oliver Wendell Holmes y William Morton, también hicieron demostraciones importantes. Por eso, a ellos se les considera los verdaderos impulsores de la anestesia.
¿Por qué ya no se usa tanto en medicina?
Hoy en día, el éter no se usa mucho como anestésico si hay otras opciones disponibles. Esto se debe a que es muy inflamable y puede irritar a algunos pacientes.
Otros usos médicos
El éter puede usarse para adormecer garrapatas. Esto se hace antes de quitarlas de un animal o una persona. Al adormecerse, la garrapata se relaja y es más fácil retirarla sin que sus partes bucales se queden bajo la piel.
¿Es peligroso el Éter Etílico?
Efectos en la salud
El éter etílico puede causar efectos de adormecimiento y anestesia. Si se inhala, puede provocar náuseas, vómito, dolor de cabeza y pérdida del conocimiento. También puede irritar las vías respiratorias. Si entra en contacto con la piel, puede causar resequedad y dermatitis. En los ojos, puede provocar irritación. En situaciones muy graves, puede detener la respiración.
Precauciones de seguridad
Debido a su alta inflamabilidad y su bajo punto de ignición (la temperatura a la que puede encenderse), el éter etílico es considerado un riesgo en los laboratorios. Es muy importante manejarlo con cuidado.
¿Cómo se comporta en el cuerpo?
Se cree que una enzima llamada citocromo P450 es la encargada de procesar el dietiléter en el cuerpo. Además, el dietiléter puede hacer que el cuerpo procese más lentamente otras sustancias.
Galería de imágenes
Véase también
 En inglés: Diethyl ether Facts for Kids
En inglés: Diethyl ether Facts for Kids