Ácido carboxílico para niños
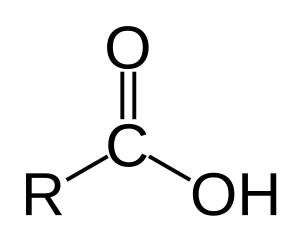
En el mundo de la química, un ácido carboxílico es un tipo de ácido orgánico. Contiene un grupo especial llamado grupo carboxilo (que se escribe como C(=O)OH) unido a una parte de la molécula que puede ser una cadena de átomos de carbono o un solo átomo de hidrógeno. Su fórmula general es R-COOH o R-CO2H, donde "R" representa esa cadena o grupo.
Los ácidos carboxílicos son muy comunes en la naturaleza. Por ejemplo, los aminoácidos, que son los bloques de construcción de las proteínas, y los ácidos grasos, que forman parte de las grasas, son tipos importantes de ácidos carboxílicos. Cuando un ácido carboxílico pierde un átomo de hidrógeno, se convierte en un anión llamado carboxilato.
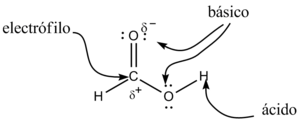
El grupo carboxilo es un grupo funcional que tiene dos partes importantes unidas al mismo átomo de carbono: un grupo hidroxilo (-OH) y un grupo carbonilo (-C=O).
Contenido
¿Cómo se nombran y dónde los encontramos?
Los ácidos carboxílicos se nombran usando la terminación "-oico" o "-ico". Para nombrarlos, se toma el nombre del hidrocarburo (una molécula hecha solo de carbono e hidrógeno) de referencia, se quita la última "o" y se añade "-oico" o "-ico", poniendo la palabra "ácido" al principio.
Por ejemplo, si tenemos el propano (CH3-CH2-CH3), el ácido que se forma a partir de él se llama ácido propanoico (propan + oico). A veces, también se le conoce como ácido propiónico.
Muchos de los primeros ácidos carboxílicos se descubrieron en la naturaleza antes de que se conociera su estructura. Por eso, algunos tienen nombres comunes que recuerdan de dónde se obtuvieron.
- El Ácido fórmico se encontró en las hormigas (formica en latín).
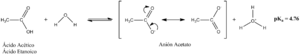
- El Ácido acético es el que le da el sabor al vinagre (acetum en latín).
- El Ácido butírico se aisló por primera vez de la mantequilla (butter en inglés).
- El Ácido láurico viene del laurel (laurus en latín).
- El Ácido palmítico se descubrió en el aceite de palma.
Ejemplos de ácidos carboxílicos comunes
Aquí tienes algunos ejemplos de ácidos carboxílicos que se encuentran en la naturaleza o son importantes:
- Ácido benzoico: Se usa en conservantes de alimentos.
- Ácido láctico: Se produce en nuestros músculos cuando hacemos ejercicio intenso y en la leche agria.
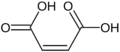
- Ácido tartárico: Presente en las uvas y el vino.
- Ácido salicílico: Un ingrediente común en productos para el cuidado de la piel.
- Ácido cítrico: El que le da el sabor ácido a los limones y naranjas.
Todos los ácidos grasos son ácidos carboxílicos. Por ejemplo, el ácido palmítico, el esteárico y el oleico. Estos ácidos, junto con la glicerina, forman las grasas que almacenamos en nuestro cuerpo, llamadas triglicéridos.
Además, todos los aminoácidos, que son los componentes básicos de las proteínas, contienen un grupo carboxilo y un grupo amino. Cuando el grupo carboxilo de un aminoácido se une al grupo amino de otro, forman un enlace peptídico, que es como un "pegamento" que une los aminoácidos para crear proteínas.
¿Cómo funcionan los ácidos carboxílicos?
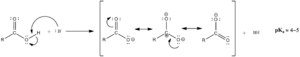
Los ácidos carboxílicos son considerados ácidos de Brønsted-Lowry. Esto significa que pueden donar un protón (un átomo de hidrógeno sin su electrón, H+). Los dos átomos de oxígeno en el grupo carboxilo son muy "egoístas" con los electrones y los atraen hacia sí, debilitando el enlace con el hidrógeno. Esto hace que el hidrógeno sea más fácil de liberar.
Cuando un ácido carboxílico pierde su protón, se forma un anión (una molécula con carga negativa) llamado carboxilato (R-COO-). La carga negativa de este anión se distribuye de manera uniforme entre los dos átomos de oxígeno, lo que lo hace muy estable.
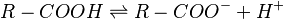
Generalmente, los ácidos carboxílicos son ácidos débiles. Esto significa que solo una pequeña parte de sus moléculas se separan para liberar protones en el agua. Sin embargo, son más ácidos que otras moléculas similares, como los alcoholes, porque la estabilidad del anión carboxilato ayuda a que se liberen más protones.
Por ejemplo, el anión que se forma del ácido acético se llama ion acetato.
¿Cómo se obtienen?
Los ácidos carboxílicos se pueden obtener de la naturaleza o fabricarse en laboratorios e industrias.
De fuentes naturales
- El ácido fórmico fue aislado por primera vez en 1671 por John Ray, quien lo obtuvo destilando hormigas rojas.
- El ácido acético se produce por bacterias en un proceso llamado fermentación acética. Es lo que ocurre cuando el alcohol etílico se convierte en vinagre. Aunque la industria química produce la mayor parte del ácido acético, el vinagre para alimentos debe ser de origen biológico.
- El ácido propiónico se forma en el cuerpo de los animales rumiantes y es parte del olor de algunos quesos y del sudor.
- Los ácidos grasos se extraen de grasas animales o vegetales.
- El ácido cítrico fue aislado por primera vez del jugo de limón en 1784. Hoy en día, se produce industrialmente usando hongos como el Aspergillus niger.
Métodos de laboratorio e industriales
Los químicos usan diferentes métodos para crear ácidos carboxílicos, dependiendo de si necesitan una pequeña cantidad para investigación o grandes cantidades para la industria.
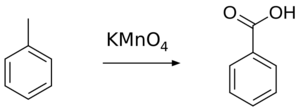
- Oxidación de hidrocarburos: Se usa aire para transformar ciertos hidrocarburos en ácidos carboxílicos. Por ejemplo, el ácido benzoico se puede obtener del tolueno.
- Oxidación de alcoholes: En el laboratorio, se pueden usar sustancias oxidantes para convertir alcoholes primarios en ácidos carboxílicos.
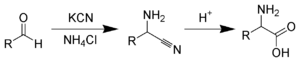
- Hidrólisis de nitrilos: Es un método común donde se usa agua para transformar nitrilos en ácidos carboxílicos.
- Carbonilación: Es un método muy versátil donde se añade monóxido de carbono (CO) a otras moléculas. Por ejemplo, el ácido acético se produce industrialmente a partir del metanol usando este método.
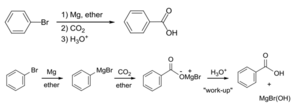
- Reacciones con reactivos de Grignard: En el laboratorio, se pueden usar reactivos especiales llamados de Grignard para formar ácidos carboxílicos a partir de dióxido de carbono.
- Síntesis de Strecker: Un método histórico para crear aminoácidos, que son un tipo de ácido carboxílico.
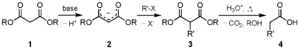
- Síntesis malónica: Un método muy útil para obtener ácidos carboxílicos más complejos.
Reacciones importantes
Los ácidos carboxílicos pueden participar en muchas reacciones químicas:
- Formación de sales: Reaccionan con bases para formar sales. Por ejemplo, el ácido acético reacciona con bicarbonato de sodio para formar acetato de sodio, dióxido de carbono y agua.
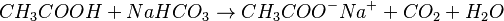
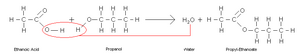
- Esterificación: Reaccionan con alcoholes para formar ésteres, que son compuestos con olores agradables, a menudo usados en perfumes y sabores.
- Formación de amidas: Reaccionan con grupos amino para formar amidas. Como se mencionó, en los aminoácidos, esto forma el enlace peptídico que une las proteínas.
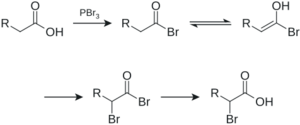
- Halogenación en posición alfa: Una reacción especial donde un átomo de hidrógeno cercano al grupo carboxilo es reemplazado por un halógeno (como cloro o bromo).
Los ésteres, anhídridos, halogenuros de ácido y amidas se conocen como derivados de ácido, ya que se forman a partir de los ácidos carboxílicos.
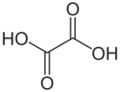
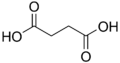
Galería de imágenes
Véase también
 En inglés: Carboxylic acid Facts for Kids
En inglés: Carboxylic acid Facts for Kids
- Anexo:Ácidos carboxílicos
- Ácido orgánico
- Equilibrio ácido-base