Ácido bórico para niños
Datos para niños
Ácido bórico |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Trihidrogeno(trioxidoborato) o Trihidroxidoboro | ||
| General | ||
| Otros nombres | Borato(III) de hidrógeno Ácido ortobórico |
|
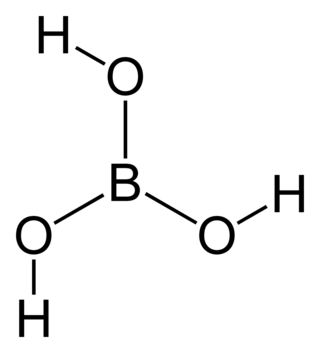
| Fórmula semidesarrollada | B(OH)3 | |
| Fórmula estructural | Véase imagen | |
| Fórmula molecular | H3BO3 | |
| Identificadores | ||
| Número CAS | 10043-35-3 | |
| ChEBI | 33118 | |
| ChEMBL | CHEMBL42403 | |
| ChemSpider | 7346 | |
| DrugBank | DB11326 | |
| PubChem | 7628 | |
| UNII | R57ZHV85D4 | |
| KEGG | C12486 D01089, C12486 | |
|
InChI
InChI=InChI=1S/BH3O3/c2-1(3)4/h2-4H
Key: KGBXLFKZBHKPEV-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Blanco cristalino | |
| Densidad | 1435 kg/m³; 1,435 g/cm³ | |
| Masa molar | 61,83 g/mol | |
| Punto de fusión | 442 K (169 °C) | |
| Punto de ebullición | 573 K (300 °C) | |
| Propiedades químicas | ||
| Acidez | 1=9,236; 2=12,74; 3=13,80 pKa | |
| Propiedades farmacológicas | ||
| Categoría embarazo | Puede perjudicar a la fertilidad. Puede dañar al feto | |
| Termoquímica | ||
| ΔfH0gas | -992.28 kJ/mol | |
| ΔfH0sólido | -1093.99 kJ/mol | |
| S0gas, 1 bar | 295.23 J·mol–1·K | |
| S0sólido | 88,7 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |  |
|
| NFPA 704 |
0
1
0
|
|
| Frases H | H360FD | |
| Frases P |
P201 P280 |
|
| Riesgos | ||
| Riesgos principales | Puede perjudicar a la fertilidad. Puede dañar al feto. | |
| Ingestión | Tóxico. Vómitos y diarrea en pequeñas dosis; en dosis mayores puede ser letal. | |
| Inhalación | Puede causar irritación. | |
| Piel | Puede causar irritación. | |
| Ojos | Puede causar irritación. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido bórico es un compuesto químico que es un poco ácido. Se usa como antiséptico (para limpiar y prevenir infecciones), insecticida (para controlar insectos), retardante de la llama (para hacer que las cosas tarden más en quemarse), y para crear otros productos químicos. También ayuda a mantener el pH (el nivel de acidez o alcalinidad) estable en algunas soluciones.
Hasta 1981, se usaba en fertilizantes para plantas y para conservar alimentos como el marisco. Sin embargo, a partir de 1983, las autoridades recomendaron usar otras sustancias. Hoy en día, su uso para conservar alimentos es ilegal.
El ácido bórico se presenta como un polvo de cristales blancos. Se disuelve fácilmente en agua. Su fórmula química es H3BO3. La forma natural de este compuesto se llama sassolita. A menudo se usa para hacer baños para los pies.
Contenido
¿Dónde se encuentra y cómo se descubrió el ácido bórico?
Fuentes naturales del ácido bórico
El ácido bórico se encuentra en la naturaleza en varios lugares. Puedes hallarlo en zonas volcánicas, como en Toscana (Italia) o Nevada (Estados Unidos). También es parte de muchos minerales, como el bórax y la colemanita.
Además, el ácido bórico y sus sales están presentes en el agua de mar. También se encuentra en las plantas, especialmente en casi todas las frutas.
Descubrimiento del ácido bórico
La historia del ácido bórico es antigua. Los boratos, que son compuestos relacionados con el ácido bórico, ya eran usados por los antiguos griegos. Los usaban para limpiar y para conservar alimentos.
El ácido bórico fue preparado por primera vez en 1702 por un científico llamado Wilhelm Homberg. Él lo obtuvo a partir del bórax, usando otros ácidos. Le dio el nombre de sal sedante de Homberg.
¿Cómo se prepara el ácido bórico?
El ácido bórico se puede preparar en un laboratorio. Una forma común es calentar bórax (un compuesto de sodio, boro y oxígeno) con un ácido inorgánico, como el ácido clorhídrico.
La reacción química es la siguiente:
- Na2B4O7·10H2O + 2 HCl → 4 B(OH)3 [o H3BO3] + 2 NaCl + 5 H2O
También se forma ácido bórico como un producto secundario cuando se mezclan ciertos compuestos de boro con agua.
Propiedades del ácido bórico
El ácido bórico se disuelve bien en agua caliente. Cuando se calienta a más de 170 grados Celsius, pierde agua y se convierte en ácido metabórico (HBO2).
El ácido metabórico es un sólido blanco que se disuelve poco en agua. Si se calienta aún más, a unos 300 grados Celsius, pierde más agua y forma ácido tetrabórico (H2B4O7). Si se sigue calentando, se convierte en trióxido de boro.
El ácido bórico no se comporta como un ácido común en el agua. En cambio, interactúa con las moléculas de agua para formar iones especiales llamados tetrahidroxiborato.
¿Para qué se usa el ácido bórico?
El ácido bórico tiene muchos usos importantes en diferentes áreas.
Usos en el hogar y la salud
- Ayuda a mantener el pH estable en algunas soluciones.
- Es un antiséptico y ayuda a eliminar bacterias.
- Es útil para cuidar la piel con acné y para limpiar quemaduras leves.
- Se usa para combatir el pie de atleta y el mal olor de pies.
- Puede usarse como insecticida para controlar cucarachas, termitas y hormigas.
Usos industriales y tecnológicos
- Es un retardante de la llama, lo que significa que ayuda a que los materiales no se quemen tan rápido.
- Se usa en la fabricación de fibra de vidrio, que se utiliza para reforzar plásticos en barcos y circuitos.
- En la industria de la joyería, ayuda a proteger los metales de la oxidación al soldar.
- Se usa en la producción de pantallas planas de LCD.
- Es un ingrediente en la fabricación de cerámica, cosméticos, cemento y porcelana.
- Se utiliza en curtidurías (para tratar pieles), imprentas y en la fabricación de jabones.
- En la metalurgia, se usa para hacer aleaciones más duras con hierro y aluminio.
Usos en energía nuclear
El ácido bórico es muy importante en las centrales nucleares. Se usa como un "veneno neutrónico". Esto significa que ayuda a controlar la velocidad de las reacciones de fisión nuclear. El boro-10, que es parte del ácido bórico, absorbe los neutrones. Al añadir ácido bórico al agua que circula por el reactor, se reduce la cantidad de neutrones que pueden causar más fisión. Esto ayuda a regular la energía que se produce.
También se disuelve en las piscinas donde se guarda el combustible nuclear usado. Esto asegura que la multiplicación de neutrones se mantenga al mínimo. Por ejemplo, se usó ácido bórico en la central nuclear de Chernóbil después del accidente para evitar más reacciones.
Otros usos interesantes
- Se añade a la sal para curar pieles de animales, lo que ayuda a controlar bacterias e insectos.
- Se usa como lubricante en algunos juegos de mesa, como el carrom, para que las piezas se deslicen mejor.
- En pirotecnia, se usa para evitar reacciones no deseadas y puede dar un color verde a las llamas.
Precauciones al usar ácido bórico
Es importante usar el ácido bórico con cuidado, ya que puede ser perjudicial si no se maneja correctamente.
- Según las normas de seguridad, se clasifica como una sustancia que puede afectar la salud reproductiva.
- Si se usa como insecticida, debe hacerse en lugares donde no sea una fuente de alimento para otros animales. Esto ayuda a mantener el equilibrio en la cadena alimentaria.
- Si se inhala o se ingiere, puede causar molestias como diarrea y vómitos. En grandes cantidades, puede ser muy peligroso.
- Las soluciones de ácido bórico para lavar los ojos o la piel dañada pueden ser especialmente perjudiciales para los bebés. Esto se debe a que su cuerpo tarda más en eliminarlo.
Galería de imágenes
Véase también
 En inglés: Boric acid Facts for Kids
En inglés: Boric acid Facts for Kids
- Ácido clorhídrico
- Borato
- Bórax
- Hidróxido
- Metanol
- Óxido básico
- Silly Putty