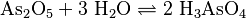Ácido arsénico para niños
Datos para niños
Ácido arsénico |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Trihidrogeno(tetraoxidoarseniato), trihidroxidooxidoarsénico | ||
| General | ||
| Otros nombres | Ácido arsénico Tetraoxoarseniato (V) de hidrógeno |
|
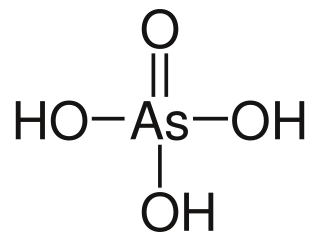
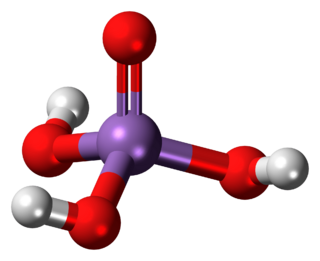
| Fórmula semidesarrollada | H3AsO4 | |
| Fórmula estructural | 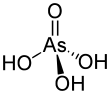 |
|
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7778-39-4 | |
| Número RTECS | CG0700000 | |
| ChEBI | 18231 | |
| ChEMBL | CHEMBL2374288 | |
| ChemSpider | 229 | |
| PubChem | 234 | |
| UNII | N7CIZ75ZPN | |
| KEGG | C01478 | |
|
InChI
InChI=InChI=1S/AsH3O4/c2-1(3,4)5/h(H3,2,3,4,5)
Key: DJHGAFSJWGLOIV-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Densidad | 2000 kg/m³; 2 g/cm³ | |
| Masa molar | 141,94 g/mol | |
| Punto de fusión | 308,65 K (36 °C) | |
| Punto de ebullición | 433 K (160 °C) | |
| Propiedades químicas | ||
| Acidez | 1=2,24; 2=6,96; 3=11,50 pKa | |
| Solubilidad en agua | 16,7 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
|
|
| Frases R | R26, R27, R28, R45 | |
| Frases S | S53, S45, S60, S61 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El ácido arsénico es un compuesto químico. También se le conoce como arseniato de hidrógeno. Su fórmula química es H3AsO4. Este ácido contiene un ion llamado arseniato, que es una partícula con carga eléctrica. En este ion, el arsénico tiene un estado de oxidación de +5. Los compuestos de arseniato se parecen mucho a los fosfatos en su comportamiento químico.
Existe otro compuesto similar, que es el ácido arsenioso.
Contenido
¿Cómo se Obtiene el Ácido Arsénico?
El ácido arsénico se forma cuando el óxido de arsénico (V) se mezcla con agua. Es una reacción química donde estas dos sustancias se combinan para crear el ácido arsénico.
La ecuación química que describe este proceso es:
¿Para Qué se Usa el Ácido Arsénico?
El ácido arsénico tiene varias aplicaciones importantes:
- Se utiliza para tratar la madera. Esto ayuda a protegerla y hacerla más duradera.
- Se usa en la fabricación de colorantes.
- También se emplea para crear otros compuestos químicos que contienen arsénico.
- En el pasado, a principios del siglo XX, los compuestos de arsénico se usaban para controlar plagas en los cultivos. Por ejemplo, se utilizaban como herbicidas (para eliminar malas hierbas) e insecticidas (para matar insectos). También se usaban para controlar roedores.
¿Cómo se Comporta el Ácido Arsénico en el Agua?
Cuando el ácido arsénico se disuelve en agua, puede cambiar de forma. Esto depende de qué tan ácida o básica sea el agua (su pH) y de las condiciones de oxidación (si hay mucho o poco oxígeno).
El arsénico puede presentarse en diferentes formas. Por ejemplo, en condiciones con mucho oxígeno y un pH bajo, una de sus formas más comunes es H2AsO4-. Si el pH es más alto, la forma principal cambia a HAsO42-.
El ácido arsénico puede liberar iones de hidrógeno en el agua en varios pasos. Esto significa que es un ácido que puede disociarse (separarse) de diferentes maneras:
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{H_3AsO_4 \rightleftharpoons \ H_2AsO_4^- \ + \ H^+}
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{H_2AsO_4^- \rightleftharpoons \ HAsO_4^{2-} \ + \ H^+}
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{HAsO_4^{2-} \rightleftharpoons \ AsO_4^{3-} \ + \ H^+}
Véase también
 En inglés: Arsenic acid Facts for Kids
En inglés: Arsenic acid Facts for Kids