Tricloruro de arsénico para niños
Datos para niños
Tricloruro de arsénico |
||
|---|---|---|
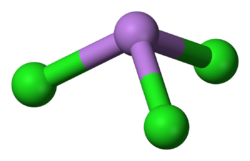 Modelo de barras y esferas
|
||
| Nombre IUPAC | ||
| Tricloruro de arsénico | ||
| General | ||
| Otros nombres | Cloruro de arsénico(III), Mantequilla de arsénico, Solución de Valagin. | |
| Fórmula estructural | 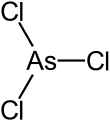 |
|
| Fórmula molecular | AsCl3 | |
| Identificadores | ||
| Número CAS | 7784-34-1 | |
| Número RTECS | CG1750000 | |
| ChEBI | 63952 | |
| ChemSpider | 22974 | |
| PubChem | 24570 | |
| UNII | 5XW39M1300 | |
|
InChI
InChI=InChI=1S/AsCl3/c2-1(3)4
Key: OEYOHULQRFXULB-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | líquido aceitoso e incoloro. | |
| Densidad | 2163 kg/m³; 2,163 g/cm³ | |
| Masa molar | 179,828 g/mol | |
| Punto de fusión | − 16,2 °C (289 K) | |
| Punto de ebullición | 130,2 °C (403 K) | |
| Viscosidad | 9,77 x 10−6 Pa s | |
| Índice de refracción (nD) | 1,6006 | |
| Propiedades químicas | ||
| Solubilidad en agua | Hidroliza. | |
| Solubilidad | soluble en alcohol, en éter, en HCl, en HBr, en cloroformo, y en CCl4. | |
| Peligrosidad | ||
| SGA |     |
|
| NFPA 704 |
0
4
1
|
|
| Frases H | H301, H310, H314, H331, H350, H410. | |
| Frases P | P201, P202, P260, P261, P262, P264, P270, P271, P273, P280, P281, P301+310, P301+330+331, P302+350, P303+361+353, P304+340, P305+351+338, P308+313, P310, P311, P321, P322, P330, P361, P363, P391, P403+233, P405, P501. | |
| Riesgos | ||
| Riesgos principales | Muy tóxico, cancerígeno, corrosivo, en contacto con el agua se descompone liberando HCl. | |
| LD50 | 48 mg/kg | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El tricloruro de arsénico es un compuesto inorgánico con la fórmula química AsCl3. También se le conoce como cloruro arsenioso o mantequilla de arsénico. Es un líquido incoloro y aceitoso, aunque a veces puede verse un poco amarillo si no está completamente puro. Este compuesto es muy importante en la fabricación de otros compuestos que contienen arsénico.
Contenido
¿Cómo es la estructura del tricloruro de arsénico?
La molécula de AsCl3 tiene una forma piramidal. Imagina una pirámide con el átomo de arsénico (As) en la punta y tres átomos de cloro (Cl) en la base. Los enlaces entre el arsénico y el cloro tienen una longitud específica, y los ángulos entre los átomos de cloro y el arsénico también son muy precisos.
¿Cómo se fabrica el tricloruro de arsénico?
Este líquido se puede obtener de varias maneras en un laboratorio o en la industria. Aquí te explicamos algunos métodos:
Fabricación a partir de óxido de arsénico
Una forma común es tratar el óxido de arsénico (III) con cloruro de hidrógeno. Después de la reacción, el tricloruro de arsénico se separa mediante un proceso llamado destilación.
As2O3 + 6 HCl → 2 AsCl3 + 3 H2O
Fabricación a partir de arsénico elemental
También se puede producir haciendo reaccionar el arsénico puro con cloro a una temperatura de entre 80 y 85 grados Celsius.
2 As + 3 Cl2 → 2 AsCl3
Otros métodos de fabricación
Existen otras formas de obtenerlo, como la reacción del óxido de arsénico con el monocloruro de azufre. Este método es bastante eficiente y no necesita equipos muy complejos.
2 As2O3 + 6 S2Cl2 → 4 AsCl3 + 3 SO2 + 9 S
También se puede preparar calentando el óxido de arsénico (III) con cloruro de tionilo.
2 As2O3 + 3 SOCl2 → 2 AsCl3 + 3 SO2
Finalmente, otra opción es hacer reaccionar el ácido clorhídrico con el sulfuro de arsénico (III).
As2S3 + 6 HCl → 2 AsCl3 + 3 H2S
¿Cómo reacciona el tricloruro de arsénico?
El tricloruro de arsénico reacciona de diferentes maneras con otras sustancias:
Reacción con agua
Cuando el tricloruro de arsénico entra en contacto con el agua, se descompone en ácido arsénico y ácido clorhídrico. Por eso, si hay humedad en el aire, puede liberar vapores.
AsCl3 + 3 H2O → As(OH)3 + 3 HCl
Formación de otros compuestos
El AsCl3 puede reaccionar con otros compuestos para formar nuevas sustancias. Por ejemplo, si se mezcla con cloruros, puede formar sales que contienen un tipo especial de ion llamado [AsCl4]-. También puede reaccionar con bromuro de potasio o yoduro de potasio para formar tribromuro de arsénico y triyoduro de arsénico, respectivamente.
Este compuesto es muy útil en la química para crear sustancias que contienen arsénico y carbono. Un ejemplo es la trifenilarsina, que se obtiene a partir del AsCl3.
AsCl3 + 6 Na + C6H5Cl → As(C6H5)3 + 6 NaCl
¿Es seguro el tricloruro de arsénico?
Es muy importante saber que el tricloruro de arsénico es una sustancia muy peligrosa. Los compuestos que contienen arsénico son conocidos por ser tóxicos, y el AsCl3 es especialmente peligroso porque se evapora fácilmente y se disuelve en agua.
Puede causar problemas de salud graves si se ingiere, se inhala o entra en contacto con la piel. También puede provocar quemaduras severas y es dañino para el medio ambiente. Por estas razones, se considera una sustancia que requiere un manejo muy cuidadoso y estricto, y las instalaciones que la producen o almacenan deben seguir reglas de seguridad muy rigurosas.
Véase también
 En inglés: Arsenic trichloride Facts for Kids
En inglés: Arsenic trichloride Facts for Kids


