Sólido amorfo para niños
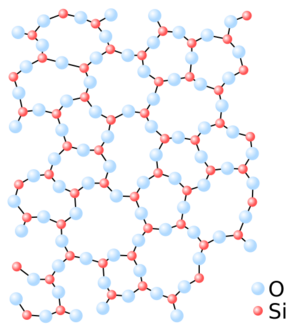
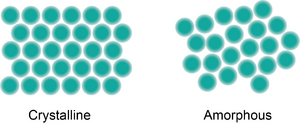
Un sólido amorfo es un tipo de material sólido donde las partículas que lo forman no tienen un patrón ordenado. Imagina que las piezas de un rompecabezas están colocadas al azar, sin seguir un dibujo. Así son los sólidos amorfos: sus átomos o moléculas están desordenados. Esto es diferente de los sólidos cristalinos, donde las partículas están muy organizadas, formando una estructura repetitiva como un patrón de ladrillos.
Muchos sólidos amorfos son mezclas de diferentes moléculas que no se pueden distinguir fácilmente. Otros están hechos de moléculas grandes y complejas. Uno de los sólidos amorfos más conocidos es el vidrio.
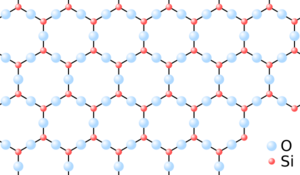
Un mismo material, si se enfría de forma diferente, puede convertirse en un sólido cristalino o en un sólido amorfo. Por ejemplo, la sílice (SiO2) puede formar el cuarzo, que es cristalino, o el vidrio, que es amorfo, dependiendo de cómo se enfríen sus moléculas.
Contenido
- ¿Qué significa "amorfo"?
- ¿Cómo son los sólidos amorfos?
- ¿Para qué se usan los sólidos amorfos?
- ¿Cómo se diferencian de los sólidos cristalinos?
- ¿Cómo se forman los sólidos amorfos?
- Polímeros: ¿Son amorfos o cristalinos?
- Vidrio: Un sólido amorfo muy especial
- Caracterización de sólidos amorfos
- Galería de imágenes
- Véase también
¿Qué significa "amorfo"?
La palabra "amorfo" viene del griego. "A" significa "sin" y "morphé" significa "figura" o "forma". Así que, un sólido amorfo es un sólido "sin forma" definida en su estructura interna.
¿Cómo son los sólidos amorfos?
Las moléculas en los sólidos amorfos están distribuidas de forma aleatoria. Esto significa que sus propiedades físicas, como la forma en que conducen el calor o la luz, son iguales en todas las direcciones. A esto se le llama ser isótropo.
Aunque no tienen un orden a largo plazo, los materiales amorfos sí tienen bloques de construcción que se conectan. Estos bloques pueden ser parecidos a los que se encuentran en la forma cristalina del mismo material. Sin embargo, como no hay un patrón que se repita a lo largo de todo el material, no se pueden describir con una "celda unitaria" (la unidad más pequeña que se repite en un cristal). Para entender su estructura, se usan métodos estadísticos.
La temperatura de transición vítrea
Los sólidos amorfos tienen una temperatura especial donde sus propiedades cambian mucho. Se llama temperatura de transición vítrea (Tg). Por ejemplo, un material que es duro y quebradizo por debajo de esta temperatura, se vuelve más blando y gomoso por encima. Es como si pasara de ser un caramelo duro a ser un chicle. Se puede bajar esta temperatura añadiendo pequeñas moléculas llamadas "plastificadores", que se meten entre las moléculas del vidrio y les dan más movimiento.
¿Cómo se funden los sólidos amorfos?
Debido a que las partículas en un sólido amorfo están desordenadas, las fuerzas que las unen no son iguales en todas partes. Por eso, cuando se calienta un sólido amorfo, no se derrite de golpe a una temperatura específica. En cambio, se va ablandando poco a poco en un rango de temperaturas. Es como la miel, que se vuelve más líquida gradualmente al calentarse. En cambio, un sólido cristalino tiene un punto de fusión muy claro y se derrite de repente.
¿Son elásticos?
Los sólidos amorfos pueden comportarse de forma elástica, como los cristales. Si se les aplica una fuerza por un tiempo, pueden deformarse de forma casi permanente, como si fueran un líquido muy espeso.
¿Son magnéticos?
Algunos metales amorfos tienen propiedades magnéticas muy interesantes. Pueden ser ferromagnéticos, lo que significa que sus pequeños imanes internos se alinean en la misma dirección, haciéndolos muy buenos para imantar.
| Sustancia amorfa | Tipo de enlace | Tg (K) |
|---|---|---|
| SiO2 | covalente | 1430 |
| GeO2 | covalente | 820 |
| Si, Ge | metálico | - |
| Pd0.4 Ni0.4 P0.2 | iónico | 580 |
| BeF2 | covalente | 570 |
| Poliestireno | covalente | 370 |
| Se | covalente | 310 |
| Au0.8 Si0.2 | metálico | 290 |
| H2O | enlace de H | 140 |
| C2H5OH | enlace de H | 90 |
| Isopentano | Van der Waals | 65 |
| Fe, Co, Bi | metálico | - |
¿Para qué se usan los sólidos amorfos?
Los sólidos amorfos se usan mucho en la industria y la construcción debido a sus propiedades especiales.
- Los óxidos amorfos, como el vidrio, son transparentes, resistentes y fáciles de moldear en láminas grandes. Por eso se usan mucho para ventanas.
- Algunos polímeros orgánicos (como los plásticos) son ligeros, resistentes y fáciles de procesar. Se usan como materiales de construcción.
- Los semiconductores amorfos se usan en memorias de ordenador y en células solares porque pueden convertir la luz en electricidad y se pueden hacer en películas muy finas.
- Los metales amorfos se usan en los núcleos de transformadores eléctricos porque son ferromagnéticos y tienen pocas pérdidas de energía.
- El calcogenuro amorfo se usa en las fotocopiadoras (xerografía) por su capacidad de conducir la electricidad cuando le da la luz.
¿Cómo se diferencian de los sólidos cristalinos?
La diferencia principal entre un sólido cristalino y uno amorfo es su estructura interna. En un cristalino, los átomos están muy ordenados a lo largo de grandes distancias. En un amorfo, no se puede saber dónde estará el siguiente átomo. Para distinguirlos, se usan varios métodos:
Difracción: ¿Cómo se ven los átomos?
La difracción es una técnica que consiste en enviar un rayo de energía (como rayos X, neutrones o electrones) sobre un sólido. Luego, se mide cómo se dispersa ese rayo en diferentes ángulos. Esto ayuda a saber cómo están organizados los átomos dentro del sólido.
Cuando el rayo choca con un plano de átomos en un sólido cristalino, se producen picos muy claros en el diagrama de difracción. Esto se debe a que los átomos están en un patrón simétrico. Analizando estos picos, los científicos pueden calcular la posición exacta de los átomos.
En un sólido amorfo, como los átomos están desordenados, el diagrama de difracción muestra pocos picos, y suelen ser muy anchos. Esto indica que no hay un orden regular.
Calorimetría: ¿Cómo absorben el calor?
La calorimetría mide cuánto calor absorbe o libera un sólido cuando se enfría y se vuelve sólido. Los sólidos amorfos tienen un alto "desorden" (llamado entropía) en comparación con los sólidos cristalinos, que están muy ordenados.
Cuando un sólido amorfo se enfría y se solidifica, el cambio de calor es muy suave y ocurre en un rango amplio de temperaturas. En cambio, un sólido cristalino muestra un cambio de calor muy marcado y rápido a una temperatura específica, que es su temperatura de cristalización.
¿Cómo se forman los sólidos amorfos?
Los sólidos amorfos pueden formarse de forma natural si los átomos no tienen suficiente tiempo o espacio para organizarse mientras el material se enfría. En 1969, un científico llamado David Turnbull sugirió que casi cualquier material podría convertirse en un sólido amorfo si se enfría lo suficientemente rápido.
También se pueden crear sólidos amorfos de forma artificial con varios métodos:
Enfriamiento rápido de un bloque
Esta técnica se usa para enfriar rápidamente metales fundidos. Se lanza un chorro de metal líquido contra la superficie de un cilindro de cobre que gira muy rápido. Esto hace que el metal se enfríe de golpe y forme una aleación amorfa.
Enfriamiento con líquido
Se pueden enfriar líquidos muy rápido usando baños de hielo. Se introducen pequeñas cantidades de material fundido en estos baños para que se enfríen a gran velocidad.
Enfriamiento al aire
Algunos materiales que tienen una tendencia natural a formar sólidos amorfos pueden enfriarse lentamente al aire, simplemente apagando el horno donde se fundieron. Ejemplos son el SiO2 (sílice), el As2S3 y el poliestireno.
Condensación de vapor
En esta técnica, se calienta un material hasta que se convierte en vapor en una cámara de vacío. Luego, este vapor choca con una superficie muy fría, y al condensarse, forma una sustancia amorfa.
Polímeros: ¿Son amorfos o cristalinos?
Los polímeros son moléculas muy grandes, como cadenas largas, hechas principalmente de carbono, hidrógeno y oxígeno. Se forman uniendo unidades más pequeñas llamadas monómeros. Esto puede ocurrir de forma natural (como en las proteínas) o artificial (para crear plásticos).
Las cadenas de los polímeros pueden enrollarse y tener grupos de átomos a los lados, lo que hace que no se empaqueten de forma muy compacta. Todo lo que dificulta que las cadenas se organicen bien, como cadenas muy largas o ramificadas, o la presencia de aditivos llamados plastificantes, favorece la formación de una estructura amorfa.
Algunos plásticos, como el polietileno o el nailon, pueden tener partes cristalinas y partes amorfas, dependiendo de cómo se hayan enfriado.
Según sus propiedades, los polímeros se clasifican en:
- Polímeros termoplásticos: Se ablandan y se vuelven líquidos al calentarlos, y se endurecen de nuevo al enfriarlos. Se pueden reciclar.
- Polímeros termoestables: No se ablandan al calentarlos; si se calientan demasiado, se descomponen. Una vez formados, mantienen su forma.
- Elastómeros: Son elásticos, como la goma. Pueden estirarse y volver a su forma original.
- Polímeros expandidos (espumas): Son porosos y ligeros, como la espuma de poliestireno. Se hacen dispersando un gas en el polímero antes de que se endurezca.
Vidrio: Un sólido amorfo muy especial
El vidrio es un sólido amorfo que tiene la estructura de un líquido, pero está "congelado". Técnicamente, es un material inorgánico que se ha enfriado tan rápido desde su estado fundido que no ha tenido tiempo de formar cristales.
Aunque a veces se usa la palabra "cristal" para referirse al vidrio, hay una diferencia importante. Un cristal es un material con una estructura atómica ordenada, como el cuarzo natural. El vidrio, en cambio, se fabrica fundiendo ingredientes como sílice, sosa y cal. Sin embargo, también existen vidrios naturales, como la obsidiana, que se forma por el calor de los volcanes.
La transición vítrea es el cambio gradual y reversible en los materiales amorfos, de un estado duro y quebradizo a uno más viscoso o gomoso, a medida que aumenta la temperatura. Un sólido amorfo que tiene esta transición se llama vidrio. El proceso inverso, cuando un líquido viscoso se enfría y se convierte en vidrio, se llama vitrificación.
Caracterización de sólidos amorfos
Como los sólidos amorfos no tienen un orden a largo plazo, las técnicas que se usan para estudiar cristales no siempre funcionan bien para ellos. Por eso, se usan otras técnicas basadas en electrones, rayos X y cálculos por ordenador para entender su estructura.
Algunos de estos métodos son:
- Difracción de rayos X y neutrones.
- Espectroscopia de rayos X.
- Tomografía electrónica atómica.
- Microscopía electrónica de fluctuación.
- Técnicas computacionales.
Galería de imágenes
Véase también
 En inglés: Amorphous solid Facts for Kids
En inglés: Amorphous solid Facts for Kids