Propileno para niños
Datos para niños
Propileno (pp) |
||
|---|---|---|
 |
||
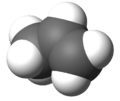
 Modelo molecular tridimensional
|
||
| Nombre IUPAC | ||
| Propeno | ||
| General | ||
| Otros nombres | Propileno Metiletileno Metileteno |
|
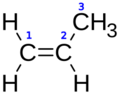
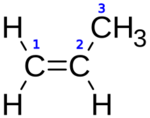
| Fórmula semidesarrollada | H2C=CH–CH3 | |
| Fórmula molecular | C3H6 | |
| Identificadores | ||
| Número CAS | 115-07-1 | |
| Número RTECS | UC6740000 | |
| ChEBI | 16052 | |
| ChEMBL | CHEMBL117213 | |
| ChemSpider | 7954 | |
| PubChem | 8252 | |
| UNII | AUG1H506LY | |
| KEGG | C11505 | |
|
InChI
InChI=InChI=1S/C3H6/c1-3-2/h3H,1H2,2H3
Key: QQONPFPTGQHPMA-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,81 kg/m³; 1,83 g/cm³ | |
| Masa molar | 42,08 g/mol | |
| Punto de fusión | 88,3 K (−185 °C) | |
| Punto de ebullición | 225 K (−48 °C) | |
| Punto de descomposición | 342 K (69 °C) | |
| Presión crítica | 46.03 atm | |
| Presión de vapor | 1020 kPa (a 20 °C) | |
| Peligrosidad | ||
| SGA |  |
|
| Punto de inflamabilidad | 165 K (−108 °C) | |
| NFPA 704 |
4
1
1
|
|
| Temperatura de autoignición | 733 K (460 °C) | |
| Frases R | R12 | |
| Frases S | S9 S16 S33 | |
| Límites de explosividad | 2,0 - 11,1% de propeno en el aire. (a 20 °C) | |
| Riesgos | ||
| Riesgos principales | Inflamable | |
| Más información | Concentración máxima permitida en los lugares de trabajo: 500 ppm (VLA-ED, ACGIH-2008). | |
| Compuestos relacionados | ||
| Alquenos | Etileno, Isómeros de Butileno | |
| Otros compuestos relacionados | Propano, 2-Propanol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
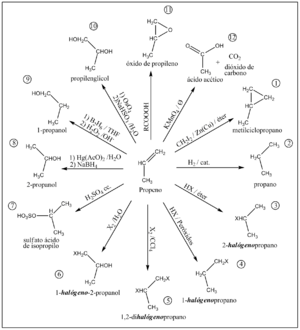
El propileno o propeno (H2C=CH–CH3) es un hidrocarburo que pertenece a los alquenos. Es un gas sin color y con un olor suave, parecido al del petróleo. Es muy similar al etileno. Como todos los alquenos, tiene un "doble enlace" en su estructura, lo que lo hace muy reactivo. Es uno de los compuestos más usados en la industria química a nivel mundial.
Contenido
¿Cómo se obtiene el propileno?
Producción a partir del petróleo
El propeno se obtiene principalmente de un proceso llamado termólisis del petróleo. En este proceso, el petróleo se calienta a temperaturas muy altas para romper sus moléculas grandes en otras más pequeñas.
Después de la termólisis, el propeno se separa de otros gases, como el etileno, usando un método llamado destilación a baja temperatura. Es como separar diferentes líquidos hirviéndolos a distintas temperaturas.
Craqueo al vapor: una técnica clave
La forma más común de producir propileno es mediante el craqueo al vapor. Esta técnica también se usa para obtener etileno. Al calentar propano con vapor, se produce una mezcla de gases que incluye etileno, propileno, metano e hidrógeno. Aproximadamente el 15% de lo que se obtiene es propileno.
En algunas partes del mundo, como Oriente Medio y Asia, se usa la nafta (un tipo de petróleo) como materia prima principal para este proceso. El propileno también se puede separar de otras mezclas de hidrocarburos que se obtienen en las refinerías.
Conversión de olefinas: una forma eficiente
Existe una tecnología que permite transformar el etileno y los 2-butenos en propileno. Esta técnica utiliza catalizadores especiales, que son sustancias que aceleran las reacciones químicas. Con este método, se puede obtener hasta un 90% de propileno.
También hay un proceso que convierte el gas de síntesis en metanol, y luego el metanol se transforma en etileno o propeno. El gas de síntesis se puede obtener del gas natural o del carbón.
Craqueo catalítico de fluidos
Otra forma de producir propileno es mediante el craqueo catalítico en lecho fluido (FCC). Este proceso se realiza a altas temperaturas y con catalizadores para obtener la mayor cantidad posible de propeno y otros productos ligeros. Las unidades de FCC suelen usar gasóleos y residuos de petróleo, y producen entre un 20% y un 25% de propeno.
¿Para qué se usa el propileno?
El propeno es un material de partida muy importante en la industria petroquímica, solo superado por el etileno. Se usa para fabricar una gran variedad de productos que usamos todos los días.
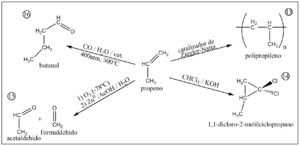
Polipropileno: el uso principal
Casi dos tercios de todo el propileno que se produce en el mundo se usa para fabricar polipropileno. El polipropileno es un tipo de plástico muy versátil.
- Películas: Se usa para hacer envoltorios y bolsas.
- Fibras: Se encuentra en alfombras, ropa deportiva y otros textiles.
- Envases y embalajes: Botellas, recipientes para alimentos y cajas.
- Tapas y cierres: Tapas de botellas y envases.
Otros productos químicos importantes
El propileno también es esencial para producir otros químicos, como:
- Óxido de propileno: Se usa para hacer espumas, plásticos y líquidos anticongelantes.
- Acrilonitrilo: Un componente para fabricar fibras acrílicas y plásticos resistentes.
- Cumeno: Se usa para producir acetona y fenol, que son importantes en la fabricación de plásticos y resinas.
- Ácido acrílico: Se utiliza para hacer pinturas, adhesivos y polímeros absorbentes.
Usos en la vida diaria
Además de los productos químicos, el propileno se usa en la industria y en talleres como combustible. Es una alternativa al acetileno para soldar, calentar metales y doblarlos.
Reacciones químicas importantes del propileno
El propileno es una molécula muy activa que puede participar en muchas reacciones químicas. Aquí te explicamos algunas de las más importantes:
Polimerización: creando plásticos
La polimerización es una reacción clave donde muchas moléculas de propileno se unen para formar una cadena muy larga, creando el polipropileno. Esta reacción se realiza con la ayuda de catalizadores especiales que permiten controlar la calidad del plástico resultante.
Hidrogenación: añadiendo hidrógeno
En esta reacción, el propileno se combina con hidrógeno en presencia de un catalizador (como el paladio o el platino). El resultado es el propano, una molécula más simple y saturada.
Adición de halógenos: formando nuevos compuestos
El propileno puede reaccionar con halógenos (como el bromo o el cloro). Dependiendo de las condiciones, se pueden formar diferentes compuestos. Por ejemplo, si se añade bromo, se obtiene un compuesto llamado 1,2-dibromopropano.
Formación de alcoholes: creando líquidos útiles
El propileno también puede transformarse en alcoholes. Por ejemplo, al añadir agua en ciertas condiciones, se puede obtener iso-propanol, que luego se puede convertir en acetona. La acetona es un solvente común.
Galería de imágenes
Véase también
 En inglés: Propene Facts for Kids
En inglés: Propene Facts for Kids