Permanganato de calcio para niños
Datos para niños
Permanganato de calcio |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Manganato (VII) de calcio | ||
| General | ||
| Fórmula estructural | 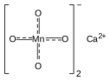 |
|
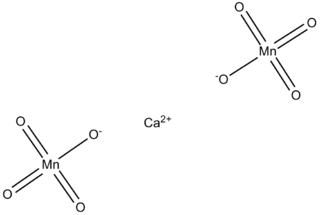
| Fórmula molecular | Ca(MnO4)2 | |
| Identificadores | ||
| Número CAS | 10118-76-0 | |
| Número RTECS | EW3860000 | |
| ChemSpider | 23333 | |
| PubChem | 24959 | |
| UNII | 720Y4E8F5H | |
|
InChI
InChI=InChI=1S/Ca.2Mn.8O/q+2;;;;;;;;;2*-1
Key: HYSMCTNXSYZEHS-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | cristales púrpura | |
| Densidad | 2490 kg/m³; 2,49 g/cm³ | |
| Masa molar | 277,9493 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | 6.38 g/100 ml at 20 °C | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
OX
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El permanganato de calcio es un compuesto químico que se presenta como cristales de color púrpura. Es un agente oxidante, lo que significa que puede hacer que otras sustancias se combinen con oxígeno o pierdan electrones.
Aunque el permanganato de calcio no se quema por sí mismo, puede hacer que otros materiales combustibles se enciendan más fácilmente o se quemen más rápido. Si se mezcla con materiales combustibles muy pequeños, la combinación podría ser explosiva. Si entra en contacto con líquidos combustibles, podría encenderlos sin necesidad de una chispa.
Las mezclas de permanganato de calcio con ciertos ácidos, como el ácido acético o el ácido sulfúrico, pueden ser peligrosas. Si no se mantienen frías, las mezclas con ácido acético pueden explotar. El contacto con ácido sulfúrico puede causar incendios o explosiones. También pueden ocurrir explosiones si el permanganato de calcio tratado con ácido sulfúrico se mezcla con sustancias orgánicas como la gasolina.
Contenido
¿Cómo se obtiene el permanganato de calcio?
Existen varias formas de producir permanganato de calcio en un laboratorio.
Producción a partir de permanganato de potasio
Una manera es combinar permanganato de potasio con cloruro de calcio. Sin embargo, esta reacción también produce cloruro de potasio, que se disuelve fácilmente en agua. Esto hace que sea un poco difícil separar el permanganato de calcio puro.
La reacción química es la siguiente:
- 2 KMnO 4 + CaCl2 → Ca(MnO4)2+ 2KCl
Para facilitar la separación, esta reacción se realiza a una temperatura baja, cerca de los 0 grados Celsius. A esta temperatura, el cloruro de potasio se disuelve menos en el agua, lo que ayuda a separarlo.
Producción a partir de permanganato de aluminio
Otra forma de obtener permanganato de calcio es haciendo reaccionar permanganato de aluminio con óxido de calcio. Esta reacción es más sencilla para la separación de productos.
Esta reacción produce un subproducto llamado alúmina (y un poco de hidróxido de aluminio), que no se disuelve en agua. Esto significa que la alúmina se puede separar fácilmente del permanganato de calcio. La reacción ocurre a una temperatura más alta y con la presencia de agua.
La ecuación de esta reacción es:
- 2 Al(MnO4)3 + 3 CaO → 3 Ca(MnO4)2 + 2 Al2O3
Después de la reacción, los productos se disuelven en agua y luego se filtran para separar el permanganato de calcio.
¿Qué reacciones químicas tiene el permanganato de calcio?
El permanganato de calcio puede reaccionar de diferentes maneras, especialmente cuando se calienta o se mezcla con otras sustancias.
Descomposición por calor
Cuando el permanganato de calcio se calienta a unos 140 grados Celsius, se descompone. Esto significa que se divide en otras sustancias: óxido de manganeso, óxido de calcio y oxígeno.
La reacción de descomposición es:
- 2Ca(MnO4)2 —t→ 2 CaO4 + 4MnO2 + 3 O2
Reacción con materiales orgánicos
Como es un agente oxidante, el permanganato de calcio puede reaccionar con materiales orgánicos. Estos incluyen sustancias como alcoholes, cetonas, aldehídos y gasolina. Cuando entra en contacto con ellos, puede causar que se enciendan o incluso exploten, a veces con solo un poco de calor.
Reacción con ácidos
Cuando el permanganato de calcio reacciona con ácido sulfúrico, forma ácido permangánico. Este ácido puede luego transformarse en heptaóxido de manganeso, que también es una sustancia explosiva.
La reacción es:
- Ca(MnO4)2 + H2SO4 → CaSO4 + 2 HMnO4 → CaSO4 + Mn2O7 + 2 H2O
Sin embargo, no reacciona de la misma manera con todos los ácidos. Por ejemplo, si se mezcla con ácido clorhídrico, libera gas cloro.
La reacción con ácido clorhídrico es:
- Ca(MnO4)2+ 22 HCl → CaCl2 + 8 Cl2 + 2MnCl2+ 8H2O + 3 H2
¿Para qué se usa el permanganato de calcio?
El permanganato de calcio tiene varios usos importantes en diferentes campos:
- Se utiliza en la fabricación de productos textiles.
- Ayuda en el proceso de blanqueo de papel.
- Se emplea para purificar el agua y en algunos procedimientos dentales.
- Funciona como un catalizador en los combustibles de cohetes, ayudando a que la reacción ocurra más rápido.
- Se usa en los recubrimientos de los electrodos de soldadura.
- En general, se utiliza como un producto para limpiar y eliminar malos olores.
Véase también
 En inglés: Calcium permanganate Facts for Kids
En inglés: Calcium permanganate Facts for Kids


