Perclorato de amonio para niños
El perclorato de amonio es un compuesto químico con la fórmula NH4ClO4. Es un tipo de sal que se forma a partir del ácido perclórico. Al igual que otros percloratos, es un material que ayuda a que otras sustancias se quemen, es decir, es un oxidante fuerte.
Este compuesto se puede obtener mezclando amoníaco con ácido perclórico. También se puede conseguir mediante una reacción entre una sal de amonio y perclorato de sodio.
NH3 + HClO4 → NH4ClO4
El perclorato de amonio es muy importante porque se usa como oxidante en los combustibles sólidos de cohetes. Por ejemplo, se ha utilizado en cohetes como el Ariane y el Transbordador Espacial de la NASA.
Datos para niños
Perclorato de amonio |
||
|---|---|---|
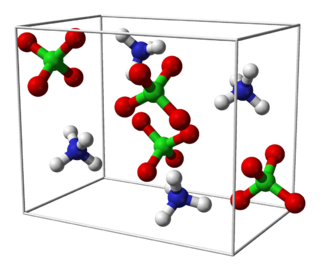 |
||
 |
||
| Nombre IUPAC | ||
| Clorato (VII) de amonio | ||
| General | ||
| Otros nombres | Perclorato de amonio Perclorato amónico |
|
| Fórmula estructural | 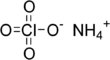 |
|
| Fórmula molecular | NH4ClO4 | |
| Identificadores | ||
| Número CAS | 7790-98-9 | |
| Número RTECS | SC7520000 | |
| ChEMBL | CHEMBL1879693 | |
| ChemSpider | 23041 | |
| PubChem | 24639 | |
| UNII | Z3DQ8VD57X | |
|
InChI
InChI=InChI=1S/ClHO4.H3N/c2-1(3,4)5;/h(H,2,3,4,5);1H3
Key: HHEFNVCDPLQQTP-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Blanco granular | |
| Densidad | 1950 kg/m³; 1,95 g/cm³ | |
| Masa molar | 117,49 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | Soluble | |
| Peligrosidad | ||
| NFPA 704 |
0
1
4
OX
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Cómo es el Perclorato de Amonio?
El perclorato de amonio, con su fórmula molecular NH4ClO4, se ve como pequeños cristales. No tiene color ni olor y se disuelve un poco en agua. Es importante saber que este material puede reaccionar de forma muy fuerte si se frota, se calienta mucho o si entra en contacto con ciertos ácidos.
También puede causar un incendio si se mezcla con materiales que se queman fácilmente. Esto incluye sustancias como el azufre, el fósforo, materiales orgánicos o pequeños trozos de metal. Si está mezclado con agua (por ejemplo, un 10% de agua), es más estable y no es tan reactivo, pero sigue siendo un oxidante. Si entra en contacto con la piel o los ojos por mucho tiempo, puede causar irritación.
¿Cómo se produce el Perclorato de Amonio?
El perclorato de amonio se puede fabricar de diferentes maneras, tanto en laboratorios pequeños como a gran escala en la industria.
Producción en Laboratorio
En un laboratorio, se puede producir perclorato de amonio de dos formas principales:
- Reaccionando ácido perclórico con hidróxido de amonio:
:Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \rm HClO_4 + NH_4OH \rightarrow NH_4ClO_4 + H_2O
- Reaccionando ácido perclórico con cloruro de amonio:
:Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \rm HClO_4 + NH_4Cl \rightarrow NH_4ClO_4 + HCl
Producción Industrial
Para producir perclorato de amonio en grandes cantidades para la industria, se usa un proceso llamado electrólisis. Primero, el cloruro de sodio (sal común) que está disuelto en agua se transforma en perclorato de sodio (NaClO4). Después, este perclorato de sodio se mezcla con una sal de amonio, como el cloruro de amonio (NH4Cl). Esta mezcla provoca una reacción que produce perclorato de amonio y cloruro de sodio.
El perclorato de amonio y el cloruro de sodio se pueden separar fácilmente porque se disuelven de manera diferente. El cloruro de sodio que se obtiene se puede usar de nuevo para empezar el proceso.
¿Para qué se usa el Perclorato de Amonio?
El perclorato de amonio se mezcla con otros materiales para crear el combustible de los cohetes de combustible sólido. También se usa en los fuegos artificiales y en los cohetes de modelismo. La razón es que el perclorato de amonio se descompone rápidamente cuando se calienta a más de 200 °C, liberando gases y mucho calor.
Los gases que se producen se expanden muy rápido debido al calor, lo que genera la fuerza necesaria para impulsar un cohete. En esta reacción, una parte del compuesto ayuda a la combustión (el oxidante) y la otra parte es el combustible (el reductor). A veces, se le añade hasta un 30% de aluminio en polvo para que la reacción sea aún más potente y genere más calor.
Aunque el perclorato de amonio no produce tanto impulso como algunos combustibles líquidos, es muy útil porque permite construir cohetes de forma más sencilla y económica. Por eso, se ha usado en cohetes como el Ariane 5, el transbordador espacial, el Titan IIIC, IVB, H-II y los cohetes Delta.
¿Es peligroso el Perclorato de Amonio?
Sí, el perclorato de amonio puede ser muy peligroso si no se maneja con cuidado. Si se quema sin control, puede causar accidentes graves. Un ejemplo de esto fue el Desastre de PEPCON el 4 de mayo de 1988, en Henderson, Nevada. En esa ocasión, hubo un gran incendio en una fábrica que producía y almacenaba perclorato de amonio para cohetes de la NASA. El evento fue muy fuerte y se pudo sentir a más de 45 kilómetros de distancia. Por eso, es muy importante seguir estrictas medidas de seguridad al trabajar con este material.
Véase también
 En inglés: Ammonium perchlorate Facts for Kids
En inglés: Ammonium perchlorate Facts for Kids




