Luciferina (molécula) para niños
Las luciferinas son sustancias especiales que usan algunos seres vivos para producir luz, un fenómeno llamado Bioluminiscencia. Esto ocurre gracias a una reacción química con el oxígeno, que es ayudada por una enzima llamada luciferasa. Durante esta reacción, la luciferina libera energía en forma de luz. Es importante saber que cada especie de animal o planta tiene sus propias luciferinas y lucifersas, que son únicas para ellos.
Contenido
- ¿Cómo se descubrieron las luciferinas?
- Características de la bioluminiscencia
- Tipos de Luciferina
- Sistemas luciferina-luciferasa no clásicos
- Usos de las luciferinas
- Galería de imágenes
- Véase también
¿Cómo se descubrieron las luciferinas?
A principios del siglo XVIII, un científico llamado René Antoine Ferchault de Réaumur notó que el polvo seco de algunos organismos que brillaban, volvía a emitir luz al mezclarse con agua.
Las primeras investigaciones importantes sobre este sistema de luz las hizo el francés Raphaël Dubois en 1885. Trabajando con luciérnagas y un tipo de molusco llamado Pholas dactylus, descubrió que había dos sustancias clave. Una de ellas se consumía (la llamó luciferina) y la otra actuaba como un catalizador (la llamó luciferasa), haciendo que se emitiera luz. La luciferina no se dañaba con el calor, pero la luciferasa sí.
Más tarde, a principios del siglo XX, el estadounidense Edmund Newton Harvey continuó estas investigaciones. Él descubrió que el sistema de luciferina-luciferasa es muy específico para cada especie. Esto significa que la luciferina de una especie no puede ser usada por otra. También se confirmó que todos los sistemas que producen luz necesitan oxígeno, algo que ya había notado Robert Boyle en el siglo XIX.
Características de la bioluminiscencia
Parece que los sistemas de Bioluminiscencia han evolucionado de forma independiente en diferentes grupos de seres vivos. Se encuentran en unos 17 grupos distintos de insectos y en al menos 700 especies más, la mayoría de ellas marinas. Se han identificado más de 30 orígenes diferentes para estos sistemas de luz.
¿Cómo funciona la luz?
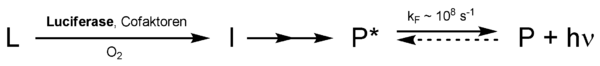
La forma clásica de entenderlo es que la luciferasa, usando oxígeno, cambia la luciferina. A veces, también se necesitan otras moléculas como el ATP o iones. La luciferina oxidada pasa por varios pasos y libera energía en forma de luz. Las luciferinas modificadas suelen ser también fluoróforos, lo que significa que pueden emitir luz si se les ilumina.
Principios de la emisión de luz
Para que la luciferina se active y emita luz, se necesita mucha energía. Por ejemplo, para emitir luz verde (500 nm), se requiere una gran cantidad de energía. Esta energía se libera en un solo paso.
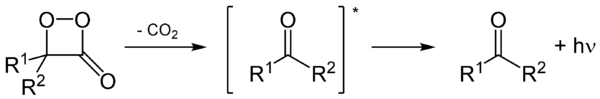
Un principio común es la creación de una estructura química llamada dioxetano. Cuando esta estructura se descompone, libera dióxido de carbono y genera una molécula activada que emite luz.
A veces, la luz no se comporta como se espera, por ejemplo, en experimentos de laboratorio. Esto puede deberse a que la energía se transfiere a otra molécula que es la que realmente emite la luz, como ocurre con la aequorina y la GFP en la medusa Aequorea victoria.
Eficiencia de la luz (Eficiencia cuántica Q)
La eficiencia cuántica (Q) mide qué tan bien una luciferina se convierte en luz. Se define como el número de fotones (partículas de luz) emitidos por cada molécula de luciferina que se transforma. El valor máximo es Q=1, lo que significa que cada molécula produce un fotón. La mayor eficiencia cuántica registrada es la de la luciérnaga Photinus pyralis, con un Q=0.41.
Tipos de Luciferina
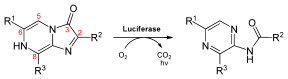
Existen varios tipos de sistemas de luciferina-luciferasa. Hay cuatro clases principales donde la luciferina se transforma para producir luz.
La luciferina de las luciérnagas
Los insectos que producen luz se encuentran en varios grupos, como los escarabajos (Coleoptera) y las moscas (Diptera). Dentro de los escarabajos, las familias Phengodidae, Elateridae y Lampyridae (luciérnagas) tienen miembros que brillan.
La luciérnaga Photinus pyralis es de la familia de las luciérnagas y fue usada en los estudios de Dubois. Es el sistema de luciferina-luciferasa más investigado.
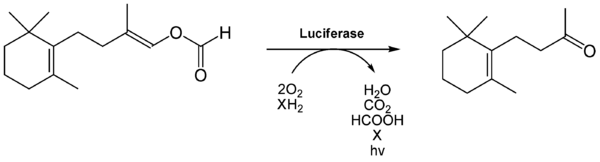
Reacción de bioluminiscencia
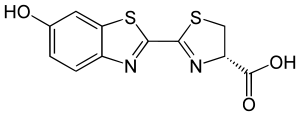
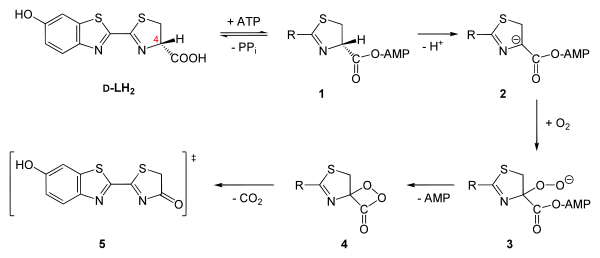
En esta reacción, la luciferasa transforma la D-Luciferina (un tipo de molécula llamada benzotiazol) usando oxígeno. Los estudios de William D. McErloy en los años 1940 mostraron que también se necesitan ATP e iones de magnesio.
La luciferina de las luciérnagas es bastante estable. La luciferasa de la luciérnaga tiene un peso de unos 61 kDa y está formada por 550 aminoácidos. Esta enzima ayuda a la luciferina a oxidarse y producir luz. La reacción ocurre en unas partes de las células llamadas peroxisomas, que están en los órganos que producen luz.
Las lucifersas de las luciérnagas son similares entre sí, pero pequeñas diferencias en su estructura determinan el color de la luz que emiten. Dependiendo de la especie, la luz puede ser verde (530 nm) o roja (635 nm).
En el laboratorio, la reacción funciona mejor a un pH de 7.8 y entre 23-25 °C. En la naturaleza, la luz es amarillo-verde o amarilla. En el laboratorio, el color puede variar mucho; en ambientes ácidos, la luz es roja, y en ambientes neutros, es amarillo-verde.
Mecanismo de reacción
El proceso de cómo se produce la luz es conocido. Primero, la D-Luciferina se activa con ATP. Luego, se oxigena y forma una estructura inestable que se descompone, liberando dióxido de carbono y formando oxiluciferina. Esta oxiluciferina está en un estado activado y, al volver a su estado normal, libera fotones (luz roja o amarillo-verde). La oxiluciferina es muy inestable y no se ha podido aislar en su forma pura.
Este mecanismo, con la formación de dioxietano, fue propuesto a finales de los años 1970. Se demostró que el oxígeno que se usa en la reacción proviene del aire, no del agua.
La eficiencia de esta reacción es alta, con una eficiencia cuántica de 0.41 a un pH de 8.5.
¿Cómo se produce la luciferina?
No se sabe con exactitud cómo los insectos fabrican la luciferina. Se ha propuesto que la oxiluciferina (el producto de la reacción de luz) podría reciclarse de nuevo a luciferina. Otra idea es que se sintetiza a partir de otras moléculas.
En una luciérnaga de Japón, Luciola lateralis, se ha demostrado que la luciferina se sintetiza a partir de una sustancia llamada 1,4-benzoquinona.
Orígenes evolutivos
Es probable que la reacción de luciferina-luciferasa de las luciérnagas haya surgido de una función biológica diferente. Se cree que la molécula de luciferina se adaptó para producir luz en la evolución. Esto se apoya en que la luciferasa también puede trabajar con otras moléculas, como los ácidos grasos, que tienen una estructura similar a la luciferina.
Esto sugiere que la luciferasa primitiva pudo haber sido una enzima que trabajaba con ácidos grasos. La aparición de la luciferina y la reacción de luz que produce pudo haber dado una ventaja a estos organismos.
Se ha visto que un escarabajo que no produce luz, el tenebrio molitor, no tiene luciferina, pero sí una enzima similar a la luciferasa. Si se le da luciferina, también puede producir luz.
Luz en otros insectos
Otros insectos que brillan, como los de las familias Phenogodidae y Elateridae, también usan la luciferina de las luciérnagas. Sus sistemas de bioluminiscencia son idénticos a los de las luciérnagas. En algunos de ellos, solo las larvas (las crías) producen luz, no los adultos.
Sin embargo, las moscas del grupo Diptera (como Arachnocampa o Orfelia) no usan la luciferina de las luciérnagas. Sus larvas, como las que viven en las cuevas de Waitomo en Nueva Zelanda, emiten luz azul.
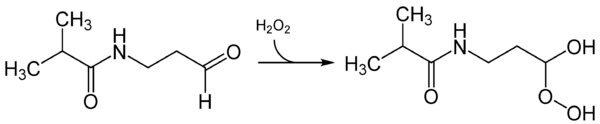
Dehidroluciferina
En el laboratorio, se ha observado que la D-Luciferina puede reaccionar sin producir luz, formando dehidroluciferina y peróxido de hidrógeno. La dehidroluciferina podría ser un inhibidor de la luciferasa. No se sabe si esto ocurre en condiciones naturales.
Tetrapirrol: la luciferina de dinoflagelados y krill
- Bioluminiscencia de dinoflagelados por el rompimiento de las olas
-
Playa cerca de Manasquan (Nueva Jersey, Estados Unidos)
-
Instantánea tomada en Manasquan
-
Dinoflagelados activos cerca de Carlsbad (California, Estados Unidos)
-
Instantánea tomada en la playa Seal Beach (California, Estados Unidos)
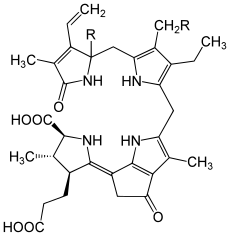
La luciferina de los dinoflagelados (algas microscópicas como Noctiluca o Gonyaulax) es un tipo de molécula llamada tetrapirrol. Estos organismos son los responsables de los "mares de ardora", que son brillos en el mar. Las investigaciones sobre este sistema comenzaron a finales de los años 1950.
Además de la luciferina y su luciferasa, se necesita una proteína que se une a la luciferina para que se emita luz. Esta luciferina es muy inestable en ciertas condiciones. Se ha demostrado que las proteínas de unión protegen la luciferina hasta que ocurre la reacción, que funciona mejor a un pH de 6.3. La reacción se lleva a cabo en unos orgánulos especiales llamados escintilones. La luz producida es azul verdosa.

No se sabe con certeza si la luciferina de los dinoflagelados proviene de la clorofila a o si se sintetiza a partir de aminoácidos.
Componente F en el krill
Una luciferina con una estructura casi idéntica se encontró en el krill (Euphausiidae), como en Meganyctiphanes norvegica. Se le llama componente F y lo obtienen a través de su alimentación. El mecanismo de reacción es similar al de los dinoflagelados.
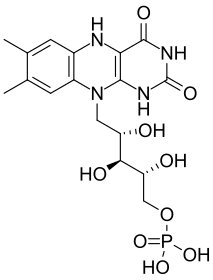
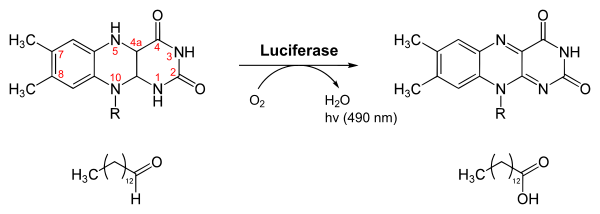
Flavina: una luciferina bacteriana
Las bacterias que brillan usan la flavín mononucleótido (FMNH2) para producir luz. Pueden ser terrestres o marinas. Muchas de ellas viven en simbiosis con peces de profundidad, en órganos especiales llamados fotóforos. Todas las bacterias bioluminiscentes conocidas hasta ahora son Gram-negativas. La más conocida es aliivibrio fischeri.
Las investigaciones sobre estas bacterias avanzaron mucho en los años 1950. Se descubrió que para la reacción se necesitan FMNH2, una luciferasa, oxígeno y un aldehído de cadena larga.
La FMNH2 y el aldehído se transforman con oxígeno en FMN y un ácido carboxílico, liberando luz. Esta reacción es catalizada por la luciferasa bacteriana. La luciferasa es una proteína formada por dos partes (subunidades α y β) y es activa en un rango de pH de 6 a 8.5, pero no a temperaturas superiores a 30-35 °C.
La FMNH2 es inestable por sí sola, pero al unirse a la enzima, se vuelve más estable y reacciona con el oxígeno. Esto lleva a una serie de pasos que terminan en la liberación de luz. La luz producida por esta reacción es azul verdosa.
La luz que se ve en la naturaleza (in vivo) puede variar de 472 a 545 nm. Esto se debe a que la energía de la reacción se transfiere a otras proteínas fluorescentes. Se han identificado dos tipos de estas proteínas: las proteínas Lumazina (LumPs) que emiten luz azul, y las proteínas fluorescentes amarillas (YFPs). La eficiencia cuántica de esta reacción está entre 0.1 y 0.16.
La FMNH2 se obtiene de la riboflavina (vitamina B2). Después de la reacción, la FMNH2 se regenera. Los aldehídos también se regeneran continuamente a partir de los ácidos grasos.
Esta reacción consume mucha energía, por lo que debe estar bien controlada en la bacteria.
Gen-Lux
Todas las proteínas relacionadas con la bioluminiscencia están codificadas por los genes llamados "gen-lux" (del latín lux: luz). Las partes de la luciferasa están codificadas por los genes luxA y luxB. Otros genes, como luxC, luxD y luxE, codifican para el complejo que regenera los aldehídos.
Coelenteracina: el químico de muchas especies marinas que brillan
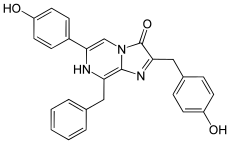
La luciferina coelenteracina fue descubierta en la pennatulacea Renilla reniformis y en la medusa A. victoria. Está presente en muchas especies marinas que producen luz, como medusas, moluscos, artrópodos y algunos peces.
La coelenteracina no se ha encontrado en animales terrestres. En algunos casos, está presente en organismos que no producen luz, pero en pequeñas cantidades.
La coelenteracina tiene una estructura básica de imidazolpirazinona y es el componente que emite luz. A menudo, está unida a proteínas que producen luz, como la aequorina.
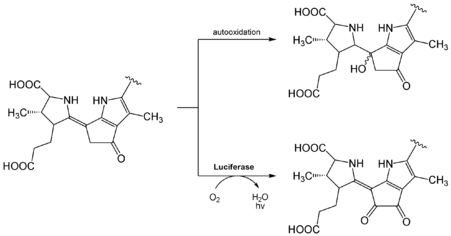
La coelenteracina sin modificar es inestable en agua y se oxida fácilmente con el oxígeno del aire. Reacciona con el aire para formar coelenteramidas, liberando dióxido de carbono y produciendo luz azul. Esta reacción puede ser catalizada por una enzima (bioluminiscencia) o ocurrir de forma espontánea (quimioluminiscencia).
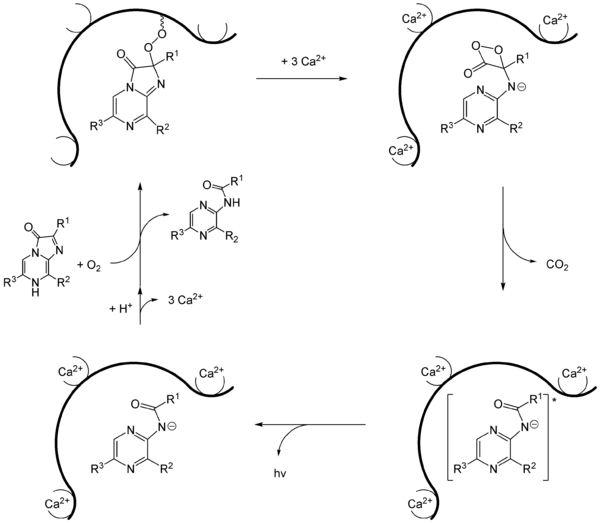
Mecanismo de acción
En 1962, se aisló la proteína aequorina de la medusa Aequorea victoria, y en 1974 se identificó la coelenteracina como su luciferina. El mecanismo de cómo funciona este sistema se demostró en el año 2000. La aequorina es una proteína que se encuentra en el borde de la medusa. La coelenteracina se une a ella. La aequorina tiene tres sitios donde se unen los iones de calcio. Cuando estos iones se unen, la proteína cambia de forma, activando una reacción con la coelenteracina. Esto forma una estructura inestable que, al liberar dióxido de carbono, produce una molécula activada que emite luz azul. Esta proteína se conoce como "proteína azul fluorescente" (BFP). La proteína se regenera con coelenteracina y oxígeno.
Sin embargo, la medusa Aequorea victoria no brilla de color azul, sino verde. Esto se debe a que la BFP transfiere la energía de la reacción a una proteína verde fluorescente (GFP).
Luciferina-Watasenia
El calamar bioluminiscente de aguas profundas Watasenia scintillans tiene muchos órganos que producen luz, que brillan como estrellas azules. Para esta reacción, se necesita una coelenteracina modificada, llamada luciferina-Watasenia. Es inestable en agua y se oxida fácilmente, produciendo luz azul.
La luciferina-Watasenia es transformada por una luciferasa que libera luz azul. La reacción funciona mejor a un pH de 8.8 y a 5 °C, usando oxígeno, ATP y magnesio. Su eficiencia cuántica es de 0.36.
Luciferina-Vargula
Los crustáceos Ostracoda de la especie Vargula hilgendorfii (también conocidos como Cypridina hilgendorfii) liberan un líquido brillante en el agua de mar cuando se sienten amenazados. Las investigaciones sobre este sistema comenzaron a principios del siglo XX.
La luciferina, llamada vargulina, se aisló en 1957. Es soluble en agua y alcohol. La vargulina es amarilla en soluciones neutras y es muy inestable, oxidándose fácilmente con el oxígeno del aire.
En estos crustáceos, la vargulina es transformada por la luciferasa en coelenteramida, liberando luz azul. La luciferasa es una proteína de 60-70 kDa.
En la reacción de bioluminiscencia, la vargulina se une a la luciferasa y se oxigena. Esto forma una estructura inestable que se descompone, formando coelenteramida activada. Al liberar fotones, vuelve a su estado normal. La eficiencia cuántica es de 0.30.
Se cree que la luciferina está formada por arginina, isoleucina y triptófano.
Coelenteracina de Symplectoteuthis oualaniensis
El calamar Symplectoteuthis oualaniensis (conocido en Japón como Tobi-ika) está muy extendido en los océanos Pacífico e Índico. Los estudios sobre su bioluminiscencia comenzaron en 1981. Este calamar usa la Coelenteracina a través de una proteína especial llamada "simplectina". Esta proteína, al descomponerse, emite luz azul. La Coelenteracina unida a la proteína se oxigena, y después de la reacción de luz, se forma coelenteramida.
El calamar relacionado Symplectoteuthis luminosa también produce bioluminiscencia con componentes similares.
Sistemas luciferina-luciferasa no clásicos
La luciferina-Latia
El caracol de agua dulce de Nueva Zelanda (Latia neritoides) tiene una luciferina que es un tipo de aldehído llamado luciferina-Latia. Es un líquido incoloro, soluble en grasas y muy hidrofóbico (no se mezcla con agua). Es inestable y puede descomponerse.
La luciferina-Latia se transforma en una cetona (oxiluciferina) por una luciferasa incolora y no fluorescente. Para la reacción, además de la luciferina, la luciferasa y el oxígeno, se necesita una proteína púrpura fluorescente. Esta proteína parece activar la reacción de luz, aunque no es indispensable. La reacción produce luz verde oscura. La eficiencia de esta reacción es muy baja.
Luciferina de Diplocardia longa
La luciferina del gusano Diplocardia longa es un aldehído simple. Lo especial de su reacción bioluminiscente es que, en lugar de oxígeno molecular, usa peróxido de hidrógeno. La luciferasa de este gusano es una enzima grande que probablemente usa cobre. Emite luz verde-azul. No se sabe cuál es el propósito de la bioluminiscencia en estos gusanos.
La eficiencia cuántica de esta reacción es bastante baja (Q=0.002).
Luciferina de Fridericia heliota
En Siberia, se descubrió en un pequeño gusano de tierra llamado Fridericia heliota una bioluminiscencia azul. Esta luz aparece al contacto o por irritación mecánica en las células de su piel. Su sistema de luciferina-luciferasa es único y no reacciona como los otros sistemas conocidos. Para la reacción, se necesita oxígeno, ATP y magnesio.
Usos de las luciferinas
Diagnóstico
Los sistemas de luciferina-luciferasa de las luciérnagas se pueden usar para detectar rápidamente la presencia de ATP. Esto es útil en la industria alimentaria para encontrar contaminación por bacterias, ya que el ATP solo está presente en organismos vivos.
Como la reacción de la aequorina depende del calcio, se puede usar para medir la concentración de calcio. Esto se usó por primera vez en 1967 para detectar cambios en las concentraciones de calcio dentro de las células musculares. Después de clonar la aequorina en bacterias, se pudo medir el calcio en el citosol bacteriano. También es posible clonar la aequorina en células de plantas, por ejemplo, para medir el calcio en plantas transgénicas después de un contacto o un choque de frío.
Técnica genética y biotecnología
Las lucifersas se usan en biología molecular como marcadores: los organismos a los que se les ha introducido el gen de la luciferasa brillan al darles luciferina. De esta manera, se puede saber si la introducción de los genes fue exitosa. Se puede unir el gen de interés con el gen de la luciferasa para identificar regiones importantes del genoma. Las lucifersas de Photinus pyralis y Renilla reniformis son las más usadas comercialmente.
Gracias a la reacción de luz, es posible medir interacciones proteína-proteína, señales en procesos de transducción de señal y la actividad de receptores celulares.
En la investigación con animales vivos (Bioimaging), se usan las lucifersas como marcadores. En la investigación sobre el cáncer, con la ayuda de estos marcadores, se puede observar el crecimiento de tumores o el desarrollo de metástasis. También se puede ver la expresión de proteínas en animales vivos usando los sistemas de luciferina-luciferasa.
Galería de imágenes
Véase también
 En inglés: Bioluminescence Facts for Kids
En inglés: Bioluminescence Facts for Kids