Sputnik V para niños
Datos para niños Gam-COVID-Vac |
||
|---|---|---|
 |
||
 |
||
| Identificadores | ||
| Código ATC | J07BX03 | |
| Datos clínicos | ||
| Nombre comercial | Sputnik V | |
| Vías de adm. | intramuscular aerosol nasal |
|
Sputnik V (en ruso, Спутник V), como nombre comercial o Gam-COVID-Vac (en ruso, Гам-КОВИД-Вак, romanizado: Gam-KOVID-Vak), como nombre con el que se registró y se produce legalmente, es una vacuna contra la COVID-19. Fue la primera vacuna contra esta enfermedad registrada en el mundo. Se desarrolló en el Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya y se registró el 11 de agosto de 2020 en Rusia con el número LP-006395 en el registro estatal de medicamentos por el Ministerio de Salud de la Federación Rusa. Está desarrollada con vectores adenovirales humanos de los que han sido desactivados sus genes reproductivos.
La vacuna fue aprobada por el gobierno ruso basándose en los estudios de fases I y II que fueron publicados el 4 de septiembre en The Lancet. Esta aprobación rápida fue criticada por medios de comunicación y miembros de la comunidad científica de Reino Unido y Alemania. Sin embargo, el análisis provisional de fase III publicado en The Lancet en febrero de 2021 indicó una eficacia del 91,6 % sin efectos adversos inusuales.
Según el Fondo Ruso de Inversión Directa (RDIF), Rusia había recibido ofertas preliminares para la compra de más de mil millones de dosis de la vacuna de esos países. La distribución masiva de emergencia de la vacuna comenzó en diciembre de 2020 en varios países, incluidos Rusia, Argentina, Bielorrusia, Hungría, Serbia y Emiratos Árabes Unidos. En febrero de 2021, 20 países habían pedido varios millones de dosis de Sputnik V para su distribución inmediata.
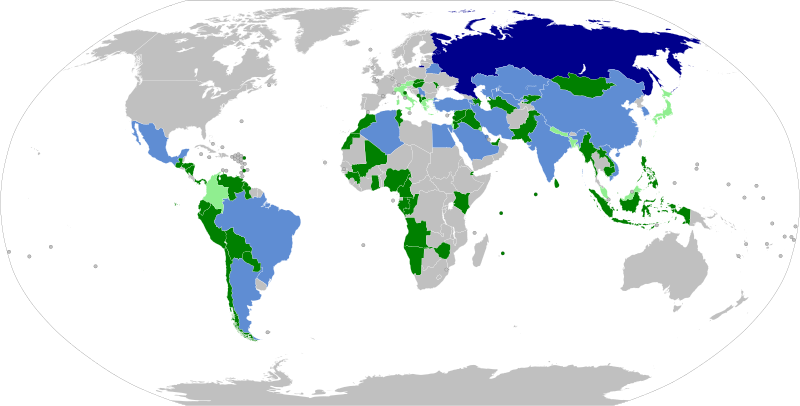
La vacuna Sputnik V ha sido autorizada, hasta diciembre de 2022, para el uso de emergencia en 74 países. A pesar de ello, algunos de estos países no han llegado a utilizarla entre su población. La población total de los países donde fue aprobada supera los 4000 millones de personas. El último país en hacerlo fue Camboya el 31 de octubre de 2021. La Federación Rusa es hasta el momento el único país en haber otorgado la aprobación permanente.
Contenido
Historia

El Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya que desarrolló la Gam-COVID-Vac fue fundado en 1891 y tiene como antecedentes haber desarrollado y registrado dos vacunas contra el ébola en 2015, así como una vacuna, en ensayos clínicos, contra el virus MERS usando también la plataforma de vectores adenovirales. Este centro de investigación cuyo director es Alexander L. Ginzburg, depende del Ministerio de Salud ruso. El desarrollo de la vacuna se realizó conjuntamente con el 48º Instituto Central de Investigación del Ministerio de Defensa ruso, que se ocupó de las etapas preclínicas y los ensayos clínicos de fase I/II y también colaboró en otras vacunas. Entre los 18 científicos desarrolladores de la vacuna también se encuentran los directores de estas instituciones científicas: A. L. Gintsburg y Sergei V. Borisevich. En febrero de 2020 el equipo científico de Denis Y. Logunov del Centro Gamaleya, comenzó la investigación de la nueva vacuna. Esta se desarrolló en el Laboratorio de Microbiología Celular del que es director y que forma parte del Departamento de Microbiología Médica del Centro Gamaleya. Denis Logunov es miembro de la Academia de Ciencias de Rusia.
El 2 de abril de 2020 el Centro de Investigación Gamaleya, hizo público que disponía de una nueva tecnología para adaptar en dos días las vacunas existentes a las nuevas variantes del SARS-CoV-2. La técnica desarrollada sobre la base de vectores adenovirales, podía sintetizar en un día una nueva secuencia a partir de la secuencia de la proteína de la espícula cuya estructura primaria era modificada, y al día siguiente incorporarla al vector utilizado. La secuenciación fue conseguida en dos semanas al partirse de una base vacunal ya conocida previamente y haber sido publicado el código genético del coronavirus por China. El 20 de abril de 2020 se obtuvieron los primeros resultados de la vacuna. Para adaptar la fábrica de vacunas que forma parte del Centro Gamaleya, completar el desarrollo y llevar los ensayos clínicos a la segunda fase hacían falta 1500 millones de rublos (aprox. 17 millones de euros), cantidad muy pequeña comparada con las inversiones de las farmacéuticas occidentales. En mayo de 2020, el Centro de Investigación de Epidemiología y Microbiología Gamaleya anunció que había desarrollado la vacuna. Los ensayos preliminares en humanos comenzaron el 18 de junio y finalizaron el de 3 de agosto de 2020, se incluyeron a 76 participantes en los dos estudios (38 en cada estudio).
La vacuna recibió el nombre comercial Sputnik V (V por vacuna), en honor al satélite artificial soviético Sputnik 1. Sputnik en español significa «compañero de viaje». La letra final V añadida a Sputnik no representa el número romano cinco, sino la V, leída uve en España o ve baja, en Latinoamérica. El Fondo Ruso de Inversión Directa, afirmó que representa la palabra vacuna y su equivalente en otras lenguas. Por ello, la lectura adecuada es «Sputnik uve» o «Sputnik ve baja». La interpretación alternativa de la V como V de victoria, tiene origen en el acto de entrega del primer lote de la vacuna entregada en Argentina el 24 de diciembre del 2020. La expresión fue pronunciada por Kirill Dmítriev, jefe del Fondo Ruso de Inversión Directa.
El 11 de agosto de 2020, el ministro de salud ruso Mijaíl Murashko anunció en una reunión con Vladímir Putin la aprobación de la vacuna. La vacuna fue registrada de forma condicional, no estando autorizado su uso masivo en Rusia hasta el 1 de enero de 2021. Hasta esa fecha solo podía ser provista a un número pequeño de ciudadanos de grupos vulnerables, como el personal médico y los ancianos, de acuerdo con un portavoz del Ministerio de Salud. Aunque el anuncio fue realizado antes de que la vacuna ingresara a fase III, esta práctica de aprobaciones condicionales también existe en otros países.
El 14 de diciembre de 2020, el Centro Gamaleya publicó datos sobre 22 714 participantes en los ensayos de fase III. En una conferencia de prensa el 17 de diciembre, el presidente Vladímir Putin dijo lo siguiente:
Los expertos nos dicen que las vacunas que entran en la circulación civil se proporcionen a ciudadanos de una determinada edad; aún no han llegado a gente como yoVladimir Putin.
Estas declaraciones causaron gran revuelo. Posteriormente Alexei Kuznetsov, asesor del Ministro de Salud de la Federación de Rusia, aclaró que, para elevar el límite superior de edad, los desarrolladores de la vacuna estaban realizando ensayos clínicos adicionales con voluntarios de más de 60 años que están mostrando buenos resultados preliminares. La entonces Secretaria de Acceso a la Salud del Ministerio de Salud argentino, Carla Vizzotti, sobre la demora de aprobación para la aplicación en adultos mayores dijo que «Los ensayos clínicos en las vacunas y en la industria farmacéutica siempre se van desarrollando y analizando por grupos y hasta ahora la recomendación de utilización era hasta los 60 años». Estos estudios estaban llegando a su fin en los últimos días de diciembre y entonces se daría la aprobación oficial. Asimismo el ministro de salud de Rusia instó a las autoridades sanitarias de fuera de Moscú a prepararse para vacunar a la mayor cantidad de adultos mayores y personas con diabetes. Tras concluir satisfactoriamente los estudios clínicos en mayores de 60 años y ser aprobados por el Ministerio de Salud de la Federación Rusa, el 27 de diciembre de 2020 el presidente Vladímir Putin tomó la decisión de vacunarse con Sputnik V. Finalmente se vacunó contra el coronavirus el 23 de marzo de 2021. No se especificó con cuál de las tres vacunas nacionales lo hizo. El 30 de junio de 2021, el presidente ruso dijo que la vacuna que recibió fue la Sputnik V, sin que hubiese más detalles o imágenes de la inoculación. En medio de una ola de contagios en Rusia, recomendó la vacunación y dijo que le habían pedido que no revelara el nombre de la vacuna utilizada, para no darle al producto una ventaja competitiva.
El presidente ruso otorgó el 12 de junio de 2021 premios estatales a los científicos que desarrollaron la vacuna insignia del país contra el coronavirus, la Sputnik V. El premio fue otorgado al Director del Centro de Investigación de Epidemiología y Microbiología Gamaleya, Alexander Gintsburg, al Director Adjunto del Centro de Investigación, Denis Logunov, y al epidemiólogo, coronel Sergey Borisevich. En junio de 2022 Denis Logunov fue elegido nuevo miembro de la Academia Rusa de Ciencias.
El 4 de febrero de 2022 el ministro de Salud, Mijaíl Murashko, señaló que la vacuna había superado todas las etapas de los ensayos clínicos por lo que la vacuna Sputnik V recibió el registro permanente en Rusia. Hasta el momento había tenido una autorización temporal de uso de emergencia (EUA) por parte del regulador ruso.
La financiación y gestión integral de la vacuna Sputnik V se lleva a cabo por un fondo de inversión estatal. El Fondo Ruso de Inversión Directa, RDIF por sus siglas en inglés, es un fondo de inversión del gobierno ruso para coinvertir en proyectos de interés para la economía rusa. En 2020 financió el desarrollo y los ensayos clínicos de la vacuna Sputnik V y continúa siendo el responsable de su producción y distribución a gran escala en asociación con otros países.
Intentos de acceso o robo de datos de la vacuna
Desde el inicio de la carrera de las vacunas contra el COVID-19 hubo acusaciones de intentos de acceso o robo informático de avances científicos entre algunos países. En julio de 2020, The New York Times publicó que piratas informáticos rusos intentaron robar la investigación de la vacuna a estadounidenses, británicos y canadienses. La Agencia de Seguridad Nacional dijo que un grupo de 'hackers' había estado tratando de robar inteligencia sobre vacunas de universidades, empresas y otras organizaciones de atención médica. Según esta agencia estadounidense, el grupo está asociado con la inteligencia rusa y es conocido como APT29 o Cozy Bear. Sin embargo, la atribución de tales ataques era imprecisa y Rusia negó su responsabilidad.
El Centro Nacional de Seguridad Cibernética del Reino Unido (NCSC) también dijo que los piratas informáticos, casi con certeza, operaban como parte de los servicios de inteligencia rusos aunque la investigación de vacunas no se había visto obstaculizada. Rusia negó su responsabilidad afirmando que no tenían información sobre quién pudo haber pirateado compañías farmacéuticas y centros de investigación en Gran Bretaña. Comprender la investigación de vacunas y otros detalles sobre la pandemia se había convertido en un objetivo principal para las agencias de inteligencia de todo el mundo. El secretario de Relaciones Exteriores del Reino Unido dijo que era completamente inaceptable que los servicios de inteligencia rusos estuvieran apuntando a quienes trabajaban para combatir la pandemia del coronavirus.
También la contraparte rusa dijo haber sufrido lo mismo de lo que se les acusaba. El 17 de julio de 2020, el director del centro que desarrolló la vacuna dijo que la tecnología que estaban usando los especialistas del Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya, había sido patentada, era única y por sus parámetros superaba las capacidades de productos similares que actualmente se estaban creando en Occidente. Creía que lo más probable era que su plan de inmunización sería lo que alguien querría copiar y que con mucho gusto compartirían con sus colegas los secretos que tenían para proteger a la población mundial del problema de la pandemia de COVID-19. El Centro Gamaleya sufrió ataques informáticos durante el desarrollo de la vacuna Sputnik V. Los servidores de la institución fueron atacados por 'hackers' durante el desarrollo de la vacuna Sputnik V.
El 22 de marzo de 2021 Rusia sospechaba que una empresa de EE.UU. estaba violando la patente de Sputnik V. Tras notificar el asunto, el director del RDIF, Kiril Dmítriev aseguró que deseaban iniciar un diálogo con esa firma, a la que no solicitarían fondos en ese momento de la pandemia, pero que la parte rusa se tomaba en serio sus derechos intelectuales por la protección de patente muy fuerte que tiene la Sputnik V debido a que fue la primera en ser registrada.
Investigación clínica
Ensayos preclínicos
En el 48º Instituto Central de Investigaciones del Ministerio de Defensa de la Federación de Rusia, dirigido por Sergey Borisevich, se llevaron a cabo las pruebas preclínicas de la vacuna Sputnik V. Las investigaciones comenzaron en abril de 2020. Los estudios preclínicos incluyeron una serie de experimentos, significativos en términos de tiempo, número de animales y número de personal involucrado, en cuanto a toxicidad, seguridad, inmunogenicidad y eficacia protectora en animales grandes y pequeños. Las pruebas se realizaron en dos especies de mamíferos sensibles: el hámster sirio dorado y dos especies de primates. Se utilizó una metodología para la evaluación cuantitativa del patógeno y un modelo de laboratorio para la reproducción de una enfermedad respiratoria aguda grave desarrollado en este Instituto. En los estudios preclínicos de la vacuna, con datos no publicados, se suscitó una sólida respuesta inmune humoral y celular en primates, que proporcionó protección contra el SARS-CoV-2. La vacuna mostró un 100 % de protección en un modelo letal de desafío (exposición directa del sujeto al virus) con SARS-CoV-2 en hámsteres inmunodeprimidos. No se observó ningún aumento de la infección dependiente de anticuerpos en los animales vacunados y desafiados con SARS-CoV-2. En los voluntarios humanos la edad media fue de 29 años. A pesar del número elevado de personal que se ofreció voluntariamente, solo ocho empleados fueron seleccionados por el Instituto para participar en los ensayos clínicos de la vacuna.
Fase I–II
Los ensayos de fase I y II se realizaron en dos hospitales en Rusia, entre el 18 de junio y el 3 de agosto de 2020. Se ensayaron independientemente dos formatos distintos de la vacuna con 76 participantes en los dos estudios (38 en cada estudio). Los estudios consistían en ensayar el formato líquido de la vacuna (Gam-COVID-Vac, ensayo NCT04436471) y en el otro la versión liofilizada (Gam-COVID-Vac-Lyo, ensayo NCT04437875). En cada estudio, nueve voluntarios recibieron adenovirus Ad26 recombinante en la fase I, nueve recibieron adenovirus Ad5 recombinante en la fase I y 20 recibieron adenovirus Ad26 y Ad5 recombinante en la fase II. Las limitaciones de los estudios incluían la corta duración del seguimiento (42 días), la inclusión solo de voluntarios masculinos en algunas partes de la fase I, el bajo número de participantes (n=76) y la ausencia de placebo o vacuna de control. En general, el estudio incluyó voluntarios bastante jóvenes. Ambas formulaciones de vacunas son seguras y bien toleradas. La mayoría de los eventos adversos fueron leves y no fueron detectados eventos adversos graves. Todos los participantes produjeron anticuerpos contra la glicoproteína SARS-CoV-2. En el día 42, los títulos de IgG fueron 14 703 con la formulación congelada y de 11 143 con la formulación liofilizada, y los anticuerpos neutralizantes fueron 49,25 con la formulación congelada y 45,95 con la formulación liofilizada, con una tasa de seroconversión del 100 %. Las respuestas mediadas por células, fueron detectados en todos los participantes en el día 28. El estudio de Gam-COVID-Vac (Sputnik V) se realizó en una sucursal del Hospital Burdenko en Moscú, una agencia del Ministerio de Defensa. En ese estudio participaron voluntarios civiles y militares. El personal militar eran empleados por contrato (no individuos reclutados para el servicio militar obligatorio). El estudio de Gam-COVID-Vac-Lyo se llevó a cabo en la Universidad de Sechenov en Moscú y todos los voluntarios en ese estudio eran civiles. Todos los participantes proporcionaron su consentimiento informado por escrito. Los dos estudios fueron revisados y aprobados por las autoridades competentes nacionales y locales correspondientes, incluido el regulador (Departamento de Regulación Estatal para la Distribución de Medicamentos, aprobaciones núms. 241 y 242) y el comité de ética del Ministerio de Salud. El 4 de septiembre de 2020 se publicaron los resultados del ensayo de fase I-II sobre 76 participantes, mostrando evidencia preliminar de seguridad y respuesta inmune.
Fase III
Desarrollo
El 25 de agosto de 2020 el Ministerio de Salud de la Federación Rusa emitió el permiso para realizar los ensayos clínicos de fase III, después de haber sido previamente registrada la vacuna. Según este registro del ensayo, con el número 450, la finalización de las fases III y IV está programada para el 31 de diciembre de 2022. Se hizo un ensayo clínico aleatorizado, doble ciego, controlado con placebo y multicentro, para determinar en paralelo la eficacia, seguridad e inmunogenicidad de la vacuna de vector combinado Gam-COVID-Vac (Sputnik V) que involucraba a 40 000 voluntarios en Moscú y se estima que se extienda hasta mayo de 2021. El ensayo esta registrado en ClinicalTrial.gov. Se incluyeron participantes de al menos 18 años, con pruebas de PCR, IgG e IgM negativas para SARS-CoV-2, sin enfermedades infecciosas en los 14 días anteriores a la inscripción y sin otras vacunas en los 30 días anteriores. Los participantes fueron asignados al azar en proporción 3 a 1 para recibir vacuna o placebo, con estratificación por grupo de edad. Los investigadores, los participantes y todo el personal del estudio estaban cegados a la asignación de grupos. La vacuna se administró (0,5 mL/dosis) por vía intramuscular en régimen de inducción-refuerzo: un intervalo de 21 días entre la primera dosis (adenovirus Ad26 recombinante) y la segunda dosis (adenovirus Ad5 recombinante). El resultado primario fue la proporción de participantes que adquirieron el COVID-19 confirmado por PCR desde el día 21 después de recibir la primera dosis. El ensayo comenzó el 7 de septiembre de 2020 y el corte de datos para el análisis se realizó el 24 de noviembre de 2020. La vacunación de los participantes en la tercera fase del ensayo finalizó en diciembre de 2020 y debían ser objeto de seguimiento durante 180 días.
Resultados
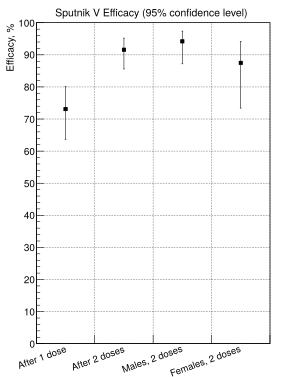
El 2 de febrero de 2021, un análisis interino del ensayo realizado en Moscú y publicado en The Lancet mostró una eficacia del 91,6 % (95 % CI 85,6–95,2) después de la segunda dosis, sin efectos adversos inusuales. El grupo de mayores de 60 años (el paciente de mayor edad tenía 87) tuvo una eficacia muy parecida a de la población general (91,8 %). La cifra se basa en el análisis de datos de 19 866 voluntarios que recibieron la primera y la segunda dosis de la vacuna o el placebo en el punto de control final con 78 casos confirmados de COVID-19. De estos casos de COVID-19, 62 casos estaban en el grupo de placebo y 16 en el grupo de la vacuna. La eficacia de Sputnik V fue validada por datos revisados por pares internacionales publicados en The Lancet. Sputnik V brinda protección total contra casos graves de COVID-19. Garantiza una respuesta inmunitaria humoral robusta (anticuerpos que son la primera línea de defensa) y mediada por células (protección a largo plazo). Los resultados del ensayo clínico de fase III demostraron altos niveles de seguridad e inmunogenicidad de las vacunas Sputnik V, incluido el grupo de edad avanzada. El nivel de anticuerpos neutralizantes del virus de los voluntarios vacunados es 1,3 - 1,5 veces mayor que el nivel de anticuerpos de los pacientes que se recuperaron de COVID-19. Más del 98 % de los voluntarios del grupo vacunado desarrollaron una respuesta inmunitaria humoral y un 100 % de respuesta inmunitaria celular. La vacuna mostró un excelente perfil de seguridad. La mayoría de los eventos adversos (94 %) fueron leves e incluyeron síndromes gripales, reacciones en el lugar de la inyección, dolor de cabeza y astenia. Ningún evento adverso grave se asoció con la vacunación, según lo confirmado por el comité independiente de monitoreo de datos (CIMD). No hubo alergias fuertes ni shock anafiláctico. La tasa general de las reacciones observadas fue de solo un 0,27 %, menos de la mitad y menos que un tercio de las vacunas más inyectadas en Occidente (0,58 % y 0,97 % respectivamente).
Otros países participantes
En los ensayos clínicos de fase III participaron más de 31 000 personas en Rusia y Bielorrusia. Otros países también se unieron, o planificaron hacerlo, al ensayo a nivel local: Emiratos Árabes Unidos, India, Venezuela, Israel además de Brasil y Arabia Saudí.
Bielorrusia En 2020 - 2021, se llevaron adelante estudios de fase III en Bielorrusia. Se realizó la prueba con 100 personas con la vacuna según el Ministerio de Salud.
Israel En agosto de 2020 el Centro Médico Hadassah israelí estaba en negociaciones específicas para participar en el próximo ensayo de fase III de la vacuna Sputnik V. A comienzos de noviembre de 2020, el director del Centro Hadassah, Zeev Rotstein, declaró que la sede en Moscú del centro ya estaba participando del ensayo clínico de fase III.
Venezuela En octubre de 2020 el ministro de Salud de Venezuela, Carlos Alvarado, informó que la fase III de los ensayos clínicos de la vacuna en Venezuela comenzaría en Caracas. El acontecimiento de la llegada del primer lote de la vacuna al país se catalogó como histórico. Venezuela fue el primer país del hemisferio occidental en participar en la fase III de los ensayos clínicos de Sputnik V. El ministro de Salud comunicó que 2000 venezolanos formarían parte de los ensayos clínicos de fase III. El proceso de selección de los voluntarios se haría a través de una página web y los elegidos pasarían por una serie de evaluaciones físicas para determinar su idoneidad.
Emiratos Árabes Unidos En enero de 2021 Emiratos Árabes Unidos comenzó a participar en los ensayos de fase III de la vacuna Sputnik V. Los participantes fueron voluntarios. El subsecretario del Departamento de Salud dijo que la realización de los ensayos clínicos es una prueba de la categoría del sector médico de Abu Dhabi. El investigador principal del ensayo de fase III en los EAU explicó que Abu Dhabi había sido elegido para desempeñar un papel clave para comprender los efectos de la vacuna en personas de diferentes nacionalidades.
India El 13 de abril de 2021, el ministro de salud de India dijo que el ente regulador vio que los datos de seguridad e inmunogenicidad del ensayo local de Sputnik V eran similares a los obtenidos en el ensayo realizado en Rusia.
Arabia Saudita En julio de 2020 Arabia Saudita participó en ensayos clínicos de fases previas con 38 y 100 personas respectivamente. Además el director del Fondo Ruso de Inversión Directa, dijo que el reino saudí podría ser parte de la fase III, que involucraría a miles de personas y que se esperaba que comenzase en agosto.
Brasil En octubre de 2020 el estado brasileño de Bahía también firmó un acuerdo para realizar ensayos clínicos de fase III de la vacuna Sputnik V, sin embargo, no estaba claro cuándo podrían comenzar dichas pruebas. Una portavoz del regulador Anvisa dijo que el gobierno de Bahía no había presentado solicitud de aprobación de sus planes para probar la vacuna, y mucho menos producirla. El secretario de salud de Bahía digo que tenían que hacer un ensayo clínico de fase III, que debería empezar en noviembre y durar hasta enero o febrero.
Ensayos posteriores
Ensayos de colaboración Sputnik V – AstraZeneca
Sputnik V fue el primer cóctel de vacunas en el mundo, ya que fue pionero en el refuerzo heterogéneo para tener mayor eficacia en la lucha contra la COVID. Las dos dosis son inyecciones diferentes, pues comportan un adenovirus diferente: Ad26 y Ad5. También fue la primera vacuna en desarrollar una asociación para combinar vacunas con AstraZeneca. Sputnik V ha destacado por ser la única vacuna para el COVID-19 hasta enero de 2023, con un concepto de vacuna heteróloga. Debido a las bajas tasas de eficiencia de algunas vacunas y las nuevas variantes, este diseño está cobrando importancia en el ámbito científico y está siendo considerada en otros países y fabricantes de vacunas. El uso de la vacuna Sputnik V como segundo componente de la vacuna de AstraZeneca, elimina la necesidad de esperar durante tres meses a la segunda dosis. El 17 de julio de 2020, se anunció la colaboración de la compañía rusa R-Pharm y la empresa farmacéutica anglo-sueca AstraZeneca para la producción en Rusia de una vacuna de adenovirus recombinante para prevenir la infección por el COVID-19. El 11 de diciembre AstraZeneca inicia el programa para evaluar combinaciones de vacunas. La empresa aceptó la propuesta del Centro Gamaleya, y el Fondo de Inversión Directa de Rusia y la empresa rusa R-Pharm y colaborará para estudiar la posible combinación de ambos medicamentos. La compañía británica AstraZeneca anunció que comenzará a reclutar personas mayores de 18 años para participar en los ensayos clínicos.
El 21 de diciembre de 2020, el Fondo Ruso de Inversión Directa (RDIF), el Centro Gamaleya, AstraZeneca y R-Pharm firmaron un acuerdo para el desarrollo y la implementación de un estudio clínico para evaluar la inmunogenicidad y seguridad del uso combinado de ambas vacunas. El estudio durará al menos 6 meses y se llevará adelante en varios países. El 8 de febrero de 2021, el Ministro de Salud de Azerbaiyán autorizó los estudios en su país e informó que comenzarían a fines de febrero de 2021. El día 24 de diciembre se puso en marcha la futura vacuna conjunta AstraZeneca-Sputnik V con la publicación de la ficha de los ensayos clínicos de fase I y fase II: NCT04684446. Es el primer acuerdo de cooperación del mundo entre fabricantes de vacuna COVID-19. El ensayo consta de 2 brazos, sin placebo, donde se inyecta a un grupo la vacuna de AstraZeneca en la primera dosis y 29 días más tarde la de Sputnik V (con el vector Ad26-S, el primer componente de Sputnik V) y al otro grupo lo mismo con el orden invertido. El 31 de diciembre el director del centro creador de la vacuna Sputnik afirmó que las vacunas de AstraZeneca y Sputnik V combinadas podrían generar una inmunidad de 2 años. El 19 de enero de 2021 se comunica que finalmente, los ensayos clínicos de la vacuna conjunta Astra Zeneca-Sputnik V comenzarían en febrero. Ucrania podría estar entre los países que tomarían parte. Los estudios empezarían el 16 de marzo hasta el 16 de noviembre de 2021. Mientras, se reclutaban los voluntarios. El 20 de febrero en la cuenta oficial de 'Twitter' de Sputnik V se anunció que los estudios clínicos ya habían comenzado.
El 28 de mayo de 2021 el Comité de Ética del Ministerio de Salud ruso rechazó la propuesta para el estudio de la combinación de las vacunas AstraZeneca y Sputnik V. La decisión se tomó en una reunión el 11 de mayo. El estudio se iba a realizar en Bielorrusia y en seis centros en Rusia, por lo que lo que aún en junio de 2021 no había comenzado el reclutamiento de voluntarios para el estudio. La compañía AstraZeneca sería la patrocinadora y R-Pharm, el Fondo de Inversión Directa de Rusia (RDIF) y el Centro Nacional de Investigación de Epidemiología y Microbiología de Gamaleya figuraban como coautores del estudio. Irina Panarina, directora general de AstraZeneca en Rusia y Eurasia, dijo que la decisión no significaba que los ensayos no sean aprobados o prohibidos definitivamente. Se estaban preparando respuestas a consultas sobre los ensayos del Ministerio de Salud ruso.
Aunque los ensayos en otros países seguían su curso, el Ministerio de Salud ruso rechazó la investigación conjunta de la vacuna Sputnik V y la producida por AstraZeneca en Rusia, debido a la falta de una serie de documentos y datos, necesarios para evaluar aspectos éticos y clínicos de la investigación, así como para caracterizar su eficacia y seguridad. Finalmente el Ministerio de Salud ruso aprobó, el 26 de julio de 2021, la investigación conjunta de la combinación de las vacunas, utilizando la versión monodosis, Sputnik Light y la vacuna de AstraZeneca. La vacuna Sputnik Light puede usarse en combinación con otras vacunas para aumentar su eficacia, incluso contra nuevas cepas. Según, Alexander Gintsburg, director del Centro Gamaleya, las células de memoria resultantes del uso de esta vacuna híbrida de dos componentes estarán mucho mejor formadas, y la vacuna protegerá a la persona vacunada no durante tres o cuatro meses, sino durante al menos dos años. Según el registro estatal de autorizaciones de ensayos clínicos, la primera y segunda fase de la investigación empezó el 26 de julio. El objetivo del estudio clínico era estudiar la seguridad e inmunogenicidad de la combinación de AZD1222 [vacuna AstraZeneca] y adenovirus Ad26 recombinante (Sputnik Light), administrada de acuerdo con el esquema heterólogo 'prime-boost' (vacunación principal seguida de un refuerzo). Los estudios se realizarían hasta el 2 de marzo de 2022 y participarían en ellos 150 pacientes. La vacuna se inyectaría por vía intramuscular y las fases I y II del estudio se llevarían a cabo en cinco organizaciones médicas. El 30 de julio de 2021 en la República de Azerbaiyán se anunciaron resultados preliminares sobre la seguridad del primer estudio clínico en el mundo sobre el uso combinado de la vacuna AstraZeneca en colaboración con la Universidad de Oxford) y el primer componente de la vacuna Sputnik V (Sputnik Light), basada en el serotipo 26 del adenovirus humano. Los estudios habían comenzado en febrero de 2021; se habían vacunado a 50 voluntarios y continuaba el reclutamiento para los ensayos clínicos. El análisis intermedio de los datos demostraba altos índices de seguridad; no había efectos adversos graves, ni tampoco casos de contagios de coronavirus después de la vacunación. En agosto de 2021 se publicarían los primeros datos. Además de Azerbaiyán, se estaba llevando a cabo la vacunación mixta de voluntarios en los Emiratos Árabes Unidos, Argentina y ya se había obtenido la aprobación por parte de los reguladores para realizar investigaciones en Rusia y Bielorrusia.
El 14 de febrero de 2022 se actualizaron datos de los ensayos clínicos de fase II del uso combinado de las vacunas Sputnik Light y AstraZeneca donde se estudió la seguridad y la inmunogenicidad. Participaron 100 voluntarios de Rusia y 100 de Azerbaiyán. Fueron seguidos durante 57 días después de recibir la primera dosis y, según resultados provisionales, la combinación de vacunas demostró un perfil de seguridad aceptable y no se registraron eventos adversos graves relacionados con la vacunación. Los datos preliminares del uso combinado de las vacunas Sputnik Light y AstraZeneca confirman la conveniencia de utilizar diferentes fármacos durante la revacunación ya que este enfoque podría proporcionar una protección segura, eficaz y a largo frente a la aparición de nuevas variantes del coronavirus. R-Pharm, uno de los promotores cree estar más cerca de completar los estudios de este ensayo. La OMS estima que la intercambiabilidad de diferentes vacunas permitirá una mayor flexibilidad en los programas de vacunación. En marzo de 2022 el Ministerio de Salud de la Federación Rusa extiende el período de ensayos clínicos de la combinación de AstraZeneca y Sputnik Light en Rusia hasta el 31 de mayo de ese año, según el registro estatal de permisos para ensayos clínicos. Los ensayos de seguridad e inmunogenicidad de la combinación heteróloga estaban originalmente programados para completarse el 2 de marzo de 2022. La investigación se lleva a cabo por tres organizaciones médicas en San Petersburgo y en dos clínicas de Moscú.
En julio de 2021 Argentina estaba en fase de estudio de la combinación de las vacunas Sputnik V, AstraZeneca y otras de su repertorio vacunal. De acuerdo con los resultados preliminares de la investigación el estudio de seguridad sobre las combinaciones de las vacunas Sputnik V no reportó ningún evento adverso grave. Como eventos posteriores a la vacunación se reportaron febrícula, dolor de espalda y en la zona de aplicación. La investigación se basa en tres cohortes de 100 voluntarios. Los datos preliminares de inmunogenicidad del estudio estarán disponibles en agosto.
El 5 de agosto de 2021 el Fondo Ruso de Inversión Directa anunció los resultados iniciales de seguridad del estudio aleatorizado, simple ciego para la evaluación de la respuesta y la seguridad de los regímenes heterogéneos que combinan el primer componente de la vacuna Sputnik V y vacunas producidas por AstraZeneca, Sinopharm y Moderna en Argentina. Se analizaron los datos de 121 voluntarios correspondientes a los grupos de combinación Sputnik V en los siguientes regímenes: Sputnik Light/AstraZeneca, Sputnik Light/Moderna, Sputnik Light/Sinopharm, Sputnik Light/Sputnik Light en comparación con el grupo control Sputnik V 1º Componente/Sputnik V 2º Componente. Los datos demostraron que tanto la combinación de Sputnik Light con otras vacunas como la vacunación con dos inyecciones de solo Sputnik Light muestran un alto perfil de seguridad sin eventos adversos graves posteriores a la vacunación. Todas las combinaciones estudiadas son seguras.
Ensayos en mayores de 60
En septiembre de 2020 varios miembros del Centro Gamaleya, de entre 70 y 80 años, habían probado la vacuna Sputnik V. Se vacunaron unas 10 o 15 personas de esta edad y todos estaban sanos y activos, seguían con su trabajo y podían hacer deporte. El propio director del Centro, microbiólogo de 68 años, también se vacunó y se sentía bien. Uno de los objetivos de los ensayos postregistro también incluía la investigación de un grupo de voluntarios mayores de 60, 70 y 80 años. El 16 de octubre de 2020 Rusia comenzó a probar la vacuna en voluntarios de más de 60 años. El estudio tenía como fin ampliar las posibilidades de aplicación del fármaco en la población de mayor edad. El 31 de octubre el jefe de investigación clínica de Sputnik V reveló la actuación de la vacuna en los voluntarios de más de 60 años. No notaron ninguna reacción indeseable, al menos en el primer grupo de pacientes, ni se observaron reacciones cutáneas, aumento de temperatura o un estado pregripal. El estudio clínico de la vacuna Sputnik V en el grupo de personas mayores solo se llevó a cabo en el Hospital Clínico Central para controlar el proceso. Se planeaba incluir a 110 personas en los estudios. El primer grupo de 28 participantes fue hospitalizado y recibió una dosis de la vacuna el 28 de octubre. No podían participar personas con cáncer, pacientes que reciben terapia inmunosupresora, con hepatitis viral, así como aquellos que han sufrido un infarto agudo de miocardio o un accidente cerebrovascular agudo reciente. Los pacientes con reacciones alérgicas también se excluyen, pero aquellos con diabetes y otras enfermedades sistémicas pueden participar. Por razones de seguridad hospitalizan a los participantes del estudio dos veces: la primera durante seis días, y dos semanas después son hospitalizados nuevamente durante tres días para recibir una segunda dosis. Durante seis meses, los médicos observarán su estado de salud.
Composición
El componente I contiene:
- Principio activo: partículas adenovirales recombinantes del serotipo 26, que ha sido modificado para contener el gen de la proteína S del virus SARS-CoV-2, en una cantidad de (1,0 ±0,5) x 1011 partículas/dosis.
El componente II contiene:
- Principio activo: partículas adenovirales recombinantes del serotipo 5, que contiene el gen de la proteína S del virus SARS-CoV-2, en una cantidad de (1,0 ±0,5) x 1011 partículas/dosis.
Los otros ingredientes (excipientes) son los mismos, cualitativa y cuantitativamente, en ambos componentes:
- Tris (hidroximetil) aminometano - 1,21 mg
- Cloruro de sodio - 2,19 mg
- Sacarosa - 25,0 mg
- Cloruro de magnesio hexahidrato - 102,0 μg
- EDTA disódico dihidrato - 19,0 μg
- Polisorbato 80 - 250 μg
- Etanol 95 % - 2,5 μL
- Agua para inyectables 0,5 mL
La variante liofilizada de la vacuna Sputnik V (Gam-COVID-Vac-Lyo), usa los mismos vectores a la misma concentración que la forma líquida, pero los excipientes son parcialmente diferentes:
- Tris (hidroximetil) aminometano - 0,24 mg
- Cloruro de sodio - 1,40 mg
- Sacarosa – 73,5 mg
- Cloruro de magnesio hexahidrato - 20,4 μg
- EDTA sal disódica sal dihidrato - 3,8 μg
- Polisorbato 80 – 50 μg
- Etanol 95 % - no utiliza
- Agua para inyectables 1,0 ml. (se usa para diluir antes de la aplicación)
La versión de la vacuna de una sola dosis, Sputnik Light usa como único vector el mismo del Componente I de la Sputnik V, es decir el del serotipo 26 en misma concentración: (1,0 ±0,5) x 1011 partículas/dosis y exactamente los mismos excipientes y en la misma concentración.
Nuevas versiones de Sputnik V
Sputnik Light
La vacuna Sputnik Light es una vacuna monodosis basada en la vacuna Sputnik V original. Su propósito es vacunar a mayor número de personas y también usarla como refuerzo de otras vacunas distintas aprovechando las ventajas de la vacunación heteróloga. Sputnik Light tiene una eficacia declarada del 79,4 %. No requiere de condiciones especiales de almacenamiento y transporte. Costará menos de 10 USD y solo se aplica una dosis.
Sputnik presentación en aerosol nasal
En 2021 científicos del Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya, desarrollaron una nueva vacuna en forma de gotas nasales. El 12 de octubre de 2021 se registró y se aprobó la realización de ensayos clínicos de fase II de la vacuna Gam-COVID-Vac nasal, aunque no se consiguió que los reguladores aprobaran un programa de prueba reducido para esta versión. En agosto finalizaron los estudios preclínicos. En la fase inicial de los ensayos en enero de 2022, participaron 5 estudiantes voluntarios de la Universidad Séchenov. La primera en recibir la variante nasal, fue la estudiante de medicina Victoria Vorsina. Al cabo de seis semanas, otras 100 personas voluntarias también se sometieron a la vacuna nasal para avanzar a una nueva fase de ensayos clínicos. Un mes más tarde, más de 50 voluntarios participantes en los ensayos clínicos no presentaban efectos secundarios. Se estimaba que los que entrasen en contacto con una persona infectada no se convertirían en portadores del virus. Este fármaco se puede usar simultáneamente con la vacuna intramuscular Sputnik Light de un solo componente. En diciembre de 2021 se estaban completando los ensayos clínicos de fase II de este fármaco. En noviembre de 2021, el presidente ruso Vladímir Putin probó la vacuna nasal afirmando que no sintió ningún efecto desagradable.
El 1 de abril de 2022 el Ministerio de Salud de Rusia registró la forma nasal de la vacuna Gam-COVID-Vac (Sputnik V) para la prevención del coronavirus. Esta vacuna, al igual que la Sputnik V, consta de dos componentes de vectores adenovirales de tipo 26 y tipo 5 y se administra mediante una boquilla rociadora especial en la cavidad nasal con un intervalo de tres semanas en dos dosis. La administración nasal de la vacuna forma una respuesta inmune humoral y celular a la infección causada por el virus. Se cree que será eficiente contra la nueva cepa ómicron. En esta etapa de ensayos de fase II, el uso está permitido en personas mayores de 18 años. El Ministerio de Salud de la Federación Rusa planeaba incluir la vacuna nasal en las recomendaciones para la revacunación contra el COVID-19. En los estudios clínicos realizados sobre seguridad, tolerabilidad e inmunogenicidad cuando se administra por vía nasal, se demostró un nivel muy alto de seguridad de la vacunación: síntomas leves generales a corto plazo y eventos adversos locales (molestias en la cavidad nasal y garganta, hinchazón e hiperemia de la mucosa nasal). Estas vacunas se dirigen a las membranas mucosas delgadas que recubren la nariz, la boca y los pulmones. Al provocar respuestas inmunitarias donde el SARS-CoV-2 ingresa por primera vez al cuerpo, las vacunas mucosas podrían, en teoría, prevenir incluso casos leves de enfermedad y bloquear la transmisión a otras personas, algo que las inyecciones no han podido hacer. Estas vacunas podrían producir inmunidad esterilizante. La vacuna nasal se aplica mediante boquillas de pulverización en la cavidad nasal. Si es vacunación primaria, entonces se usan los dos componentes, y si es un refuerzo entonces un solo componente. A finales de abril de 2022 se esperaba comenzar la tercera etapa de los ensayos clínicos de la vacuna nasal. En el estudio participarían 500 voluntarios adultos y duraría hasta diciembre de 2023.
El desarrollo y producción del fármaco se realizaría en conjunción con la empresa farmacéutica rusa Generium con sede en Moscú. El 14 de abril de 2022 el director del Centro Gamaleya comunicó que los estudios clínicos posteriores al registro comenzarían en dos semanas. Los ensayos de fase III de la forma nasal de Sputnik V podrían demostrar experimentalmente, que después de la vacunación la persona tendría inmunidad estéril. Esta vacuna es la primera vacuna nasal registrada del mundo contra el COVID-19. Según el Ministro de Salud podría incluirse en las recomendaciones para la revacunación de la población. En agosto de 2022 comenzó en la ciudad rusa de Kursk la vacunación con la versión nasal. Aunque la variante nasal de la vacuna Sputnik V se empezó progresivamente a dispensar en agosto de 2022, otras vacunas no inyectables se desarrollaron y utilizaron en fechas cercanas: en Shanghái se anunció en septiembre una vacuna que se comenzó a administrar por vía de aerosol oral el 26 de octubre de 2022. Otra vacuna en la India, anunciada el 6 de septiembre de 2022, que se administra en forma de gotas en la nariz. Junto con otra fabricada en Irán y la Sputnik nasal eran varias las vacunas mucosas aprobadas en el mundo. En 2022 más de 100 vacunas mucosas contra la enfermedad estaban en desarrollo en todo el mundo y unas 20 habían llegado a ensayos clínicos en humanos. El 4 de julio de 2022 se registró en Rusia una segunda vacuna nasal desarrollada por la empresa rusa Generium llamada Salnavac. Es también una vacuna de vector combinado que consta de dos componentes de vectores adenovirales de tipo 26 y 5. El 30 de agosto, una tercera vacuna nasal rusa, Corfluvec, fue autorizada por el Ministerio de Salud ruso al Instituto de Investigación de Influenza Smorodintsev para comenzar los ensayos clínicos.
En octubre de 2022 comenzaron a entregarse en hospitales de Udmurtia 40 000 boquilllas para la vacuna nasal Sputnik. También estuvo disponible la vacuna nasal Sputnik en varios puntos de vacunación en Moscú. La revacunación se debería hacer después de seis meses, además de recomendarse la vacunación con una vacuna nasal seis meses después de sufrir COVID-19. El 31 de octubre el Ministerio de Salud anunció que la vacuna nasal desarrolla inmunidad al coronavirus después de 14 días. Se induce una respuesta inmune local y general persistente y protege contra un curso severo de la enfermedad y la muerte. En noviembre de 2022 el Centro Gamaleya esperaba órdenes del gobierno para que, a través del Ministerio de Salud, se diese el visto bueno para la fabricación masiva de la vacuna nasal en los centros de producción Generium, Binnopharm, Biocad y R-Pharm. En un mes o mes y medio se esperaban completar todos los ensayos clínicos.
Sputnik M para niños y adolescentes
Gam-COVID-Vac-M (12 - 17 años)
En 2021 se creó una nueva versión de Sputnik V llamada Gam-COVID-Vac M o Sputnik M. Es una vacuna diseñada para aplicar a adolescentes de entre 12 y 17 años. Difiere de la Sputnik V solo en su dosis ya que en lugar de 100 mil millones de partículas virales la dosis de Sputnik M es cinco veces menor. El 5 de junio comenzaron en Moscú los ensayos clínicos de esta vacuna. Los primeros adolescentes se inocularon el 6 de julio de 2021. En total, se vacunaron cincuenta niños de entre 12 a 17 años, sin registrarse complicaciones locales ni generales. El 24 de septiembre de 2021 la viceprimera ministra rusa anunció el registro de la vacuna Sputnik M para niños de 12 a 17 años. La vacuna podría estar disponible para la población a partir de finales de diciembre de 2021. La vacuna induce la formación de respuesta inmune celular y humoral a la infección de coronavirus. La inmunización con Gam-COVID-Vac M moduló la inmunidad en el 93,2 por ciento de los voluntarios. La versión Sputnik M contiene una sustancia activa igual a la de la vacuna original. Consta de 2 dosis de 0,5mL para inyección intramuscular, que se presenta congelada. Tanto el componente I (serotipo 26) y el II (serotipo 5) se compone de partículas adenovirales recombinantes que contienen el gen de la proteína S del virus SARS-CoV-2 en (2,0 ±1,5) × 1010 partículas por dosis. Esto equivale a 5 veces menos que lo contenido en la vacuna Sputnik V. Los excipientes son exactamente los mismos que en la vacuna original.
En enero de 2022, Sputnik M entró en la tercera etapa de ensayos clínicos. El único efecto secundario de este medicamento es un ligero aumento de la temperatura, hasta un máximo de 37,4 °C. Todavía no se conocen los efectos a largo plazo de la vacunación con Sputnik M. El creador de la vacuna original, D. Logunov, dijo que esta variante para adolescentes no produce miocarditis. En febrero de 2022 se sugirió que esta fórmula era tan eficaz contra la variante ómicron del coronavirus como lo es la versión original por lo que se estaba negociando su comercialización mundial. A finales de mayo de 2022 las pruebas preliminares con Sputnik M demostraron la efectividad y seguridad de la vacuna. Habían participado hasta 1500 adolescentes. No hubo reacciones adversas graves en los vacunados. Solo en casos aislados se observaron reacciones menores: un ligero aumento de la temperatura, fatiga y dolor en el lugar de la inyección de duración de hasta un día.
Gam-COVID-Vac-D (6 - 11 años)
En diciembre de 2021 se solicitó el permiso para la realización de ensayos clínicos de la vacuna para la franja de niños de 6 a 11 años. El 24 de enero de 2022, el Ministerio de Salud ruso aprobó la realización de estos ensayos para esa franja de edad. Finalmente el 3 de junio de 2022 comenzaron los ensayos clínicos de la vacuna. El gobierno había asignado 305,5 millones de rublos al Centro Gamaleya para los estudios de inmunización de niños de 6 a 11 años. Se estimaba que esta variante de la vacuna, no tendría que registrarse de modo independiente a la usada en la franja de 12 a 17 años si se demostrase la validez de la concentración final de la Sputnik V original de 1 a 5. Simplemente se ampliarían las instrucciones de la vacuna ya que el registro sería mucho más rápido debido a que esta concentración ya se recomienda para niños en un grupo de mayor edad. En el estudio a los niños se les administra la vacuna en las concentraciones de 1 a 5 y de 1 a 10. El nivel de anticuerpos neutralizantes del virus mostrará qué concentración es la adecuada. Los primeros 15 niños que recibieron el medicamento en una dosis de 1 a 10 de la de adulto se sienten muy bien excepto por un ligero aumento de la temperatura. Para este grupo de edad también se podría recomendar la vacuna en forma de aerosol intranasal, que ha demostrado una ausencia total de efectos secundarios. Se contemplaba que con la financiación adecuada se podría dar más rápidamente esta vacuna a la población de 0 a 6 años.
El director del Centro Gamaleya cree que la única forma de resolver los problemas de la pandemia es la introducción de Sputnik V en el calendario de vacunación. A nivel legislativo, esto significaría que toda la población debería vacunarse sin falta. El 31 de enero de 2023 el Centro Gamaleya solicitó el registro de la vacuna contra el COVID-19 para niños de 6 a 11 años. La información relacionada fue publicada en el registro estatal de medicamentos y la vacuna se denominó Gam-COVID-Vac-D. Se administrará por vía intramuscular y se prevé que sean dos dosis.
Sputnik V adaptada a delta y ómicron
El 23 de agosto de 2022 el Centro Gamaleya y el Fondo Ruso de Inversión Directa comunicaron el desarrollo de la vacuna Sputnik V adaptada contra las variantes del coronavirus delta y ómicron. Los estudios continuados de las variantes llevaron a adaptar la Sputnik V a las variantes dominantes en ese momento en todo el mundo. Esta versión incluía la mutación L-452-R en la variante de preocupación ómicron BA.5 que no estaba presente en la variante BA.1. Se cree que la nueva versión de Sputnik V podría mejorar la efectividad en comparación con vacunas similares combinadas contra la cepa original (Wuhan) y ómicron. La producción de la vacuna actualizada contra el coronavirus comenzaría después de que se completara la evaluación de su efectividad. Los desarrolladores tardarían unos dos meses en realizar el trámite y poder poner en marcha las instalaciones de producción en el país. A pesar de que la versión actual de la vacuna Sputnik V existente tiene buenos resultados en la prevención de hospitalizaciones y muertes, funciona peor contra el nuevo ómicron en comparación con las cepas anteriores, según el director del Centro Gamaleya, Alexander Gintsburg. Se está a la espera del Ministerio de Salud para que introduzca una regulación que permita reemplazar una composición antigénica de Sputnik V por otra. Se pretende demostrar que la vacuna es efectiva y segura, pero al mismo tiempo no alargar el estudio al máximo. En investigaciones equivalentes en otros países se está siguiendo este mismo camino.
En septiembre de 2022 se transfirió a producción la nueva versión de la vacuna Sputnik V, donde se prepararía para ensayos clínicos de eficacia contra las cepas de coronavirus delta y ómicron. Durante las pruebas previas se registró una disminución significativa de la carga viral en los pulmones en animales infectados con la cepa ómicron BA.5. El 30 de noviembre de 2022 la vacuna contra las cepas de coronavirus delta y ómicron, del Centro Gamaleya, fue patentada en Rusia. Se esperaba que los ensayos de la vacuna se completarían a finales de 2022.
Los especialistas del Centro de Investigación Gamaleya han empezado a ensamblar una nueva vacuna contra la variante de ómicron XBB.1.5 llamada 'kraken'. Creen que la composición antigénica de la vacuna debería renovarse cada 9 o 10 meses, ya que el SARS-CoV-2 está mutando para evadir la inmunidad.
Seguridad
Seguridad en el diseño y antecedentes
La plataforma tecnológica en la que la vacuna Sputnik V fue creada es un vector viral, el instrumento utilizado para la entrega de material genético a las células. Esta tecnología se utilizó por primera vez en la década de 1970. Sputnik V utiliza un vector viral no replicable, es decir un virus carente de un mecanismo de reproducción, por lo que no representa ningún riesgo de infección para el organismo. El vector es utilizado para transportar material genético de otro virus, contra el cual se hace la vacuna. Específicamente, se usa un vector de adenovirus en la vacuna Sputnik V. Los adenovirus extraídos de los adenoides humanos que normalmente causan infecciones respiratorias agudas, ya fueron usados en la década de 1990 para la creación de vectores. La tecnología del uso de vectores de adenovirus es segura y eficaz, lo que se confirma en numerosos estudios. Sobre esta plataforma tecnológica se han realizado más de 250 estudios clínicos, y se han realizado o se están realizando estudios de seguridad a largo plazo, incluyendo la ausencia de riesgo de carcinogenicidad o de reducción de la fecundidad por el fármaco.
Todas las vacunas para el COVID-19 basadas en plataformas de vectores adenovirales son diferentes y no son comparables directamente. Una utiliza un adenovirus de chimpancé para entregar el antígeno, que consta de proteína-S combinada con el activador del plasminógeno y 2 vectores idénticos. Otra vacuna utiliza adenovirus humanos de serotipo Ad26 y proteína-S de larga duración estabilizada por mutaciones que se produce mediante el uso de la línea celular humana PER.C6 (células retinales embrionarias). Sputnik V es una vacuna de dos componentes en la que se utilizan los serotipos de adenovirus 5 y 26. En esta no se usan fragmentos del activador plasminógeno de tipo tejido y el antígeno de inserción es una proteína-S de longitud completa sin modificar. La vacuna Sputnik V se produce con la línea celular HEK293, que durante mucho tiempo ha sido utilizada de forma segura para la producción de productos biotecnológicos. Todas las anteriores vacunas basadas en vectores adenovirales tienen diferencias significativas en su estructura y tecnología de producción, por lo que no hay razón para extrapolar datos de seguridad de una vacuna para los datos de otras.
El 21 de abril de 2021, la Universidad de Greifswald (Alemania) intentó explicar los mecanismos que provocan los raros cuadros de trombosis con plaquetas bajas. Se sabe que alguna vacuna homologada incluye proteínas celulares arrastradas durante el proceso de fabricación que podrían favorecer la reacción autoinmune, lo que crea dudas sobre si otras vacunas basadas en adenovirus también estarán afectadas. Si el origen del problema estuviese en el procesado de la vacuna esto explicaría que no se hayan encontrado casos asociados a la vacuna Sputnik V, cuyos responsables argumentan que su producto está altamente purificado mediante una tecnología de cuatro fases.
Según un artículo publicado en febrero de 2021 en la revista médica The Lancet, la vacuna Sputnik V es segura en su aplicación. El profesor Ian Johnson de Reino Unido, comentó este artículo reconociendo la eficacia y seguridad de esta vacuna. El 3 de febrero la investigadora y viróloga española Margarita del Val, que anteriormente formó parte de la EMA, valoró la vacuna Sputnik V diciendo que la vacuna rusa era fiable, muy buena y muy segura. Añadió que no tiene efectos adversos importantes de ningún tipo. El día 20 de agosto de 2020 se publicaron las instrucciones de Uso de la vacuna rusa Sputnik V: posibles efectos secundarios y contraindicaciones. El Ministerio de Salud de Argentina en febrero de 2021, publicó el Manual del vacunador de la Sputnik V, donde se informa muy detalladamente de todas las precauciones de seguridad.
Datos de seguridad en ensayos clínicos
La publicación de los resultados de los ensayos de fase I y II, el 4 de septiembre de 2020, indica que ambas formulaciones de vacunas son seguras y bien toleradas. Los eventos adversos más comunes fueron dolor en el sitio de inyección (44 [58 %]), hipertermia (38 [50 %]), dolor de cabeza (32 [42 %]), astenia (21 [28 %]) y dolor muscular y de articulaciones (18 [24 %]). La mayoría de los eventos adversos fueron leves y no fueron detectados eventos adversos graves. En la primera semana de vacunación de voluntarios en los ensayos de fase III se informó de efectos secundarios menores en el 14 % de los voluntarios. En diciembre de 2020 Alexander Gintsburg, director del Centro Gamaleya, afirmó que la vacuna presentó efectos secundarios leves en el 15-16 % de los vacunados y estos se limitaron a fiebre de 38 °C hasta 48 horas, dolor de cabeza y malestar muscular. No hubo hospitalizaciones de los voluntarios. En los ensayos de fase III de la vacuna, publicados el 20 de febrero de 2021, entre las personas que recibieron la vacuna la mayoría de los eventos adversos fue de grado 1 (7485 de los eventos) y 45 voluntarios con la vacuna y 23 con placebo tuvieron importantes efectos secundarios, pero ninguno de ellos fue reconocido que tuviese relación con la vacunación. Durante el estudio fallecieron cuatro de los sujetos de prueba: 3 de 16 427 vacunados y 1 de 5435 en el grupo de placebo. Ninguno asociado con la vacuna. De los fallecidos en el grupo de vacunados, una muerte estuvo relacionada con fractura de las vértebras torácicas, dos tuvieron COVID-19. Estos desarrollaron síntomas en el 4.° y el 5.° día después de la primera dosis de la vacuna (por lo tanto, ambos fueron infectados antes de la inclusión en el estudio a pesar de un resultado negativo de PCR), ambos tenían comorbilidades (enfermedades cardiovasculares y endocrinológicas, respectivamente). El fallecido en el grupo de placebo, murió de un derrame cerebral hemorrágico. Al final del estudio, hubo 62 casos confirmados de contagio de COVID-19 en el grupo de placebo y solo 16 en el grupo de la vacuna. No hubo alergias significativas o shock anafiláctico. Se siguen realizando estudios de seguridad a largo plazo incluyendo ausencia de riesgo de carcinogenicidad y reducción de la fecundidad. Según la publicación los datos de efectos adversos fueron confirmados por un Comité de Monitoreo de Datos Independiente. Hasta el momento, día 16 de marzo de 2021, no se han reportado muertes ni casos graves de COVID-19 entre los vacunados con Sputnik V, según el director del centro Gamaleya. Expertos independientes de varios países informaron de la ausencia de efectos secundarios graves después de la inyección.
Datos de seguridad en campañas de vacunación
La revista Nature publicó el 6 de julio de 2021 que las evidencias obtenidas en Rusia y otros países sugieren que la vacuna Sputnik V es segura y eficaz. Los estudios señalan que los efectos secundarios son semejantes a los de otras vacunas de vectores adenovirales humanos, con la excepción de casos de trombosis. Ni un solo país había registrado casos de trombosis a causa de Sputnik V. Los datos obtenidos en Argentina, Brasil y San Marino indicaron la ausencia de efectos secundarios serios tras las inoculaciones. Argentina no ha reportado ningún caso de coagulación vinculado a la vacuna a pesar de recibir más de cuatro millones de dosis de la vacuna. Serbia, que también ha estado utilizando ampliamente la Sputnik V, tampoco notificó hasta ahora casos de coagulación sanguínea. La viróloga canadiense Alyson Kelvin dijo que existe la teoría de que el trastorno de la coagulación está asociado con las vacunas de vectores virales, pero no creía que se conociese la causa exacta de que componente de esas vacunas lo estaba causando, o si Sputnik V también podría verse afectado. Aunque el estudio de fase III de Sputnik V inscribió a 21 977 personas era demasiado pequeño para detectar eventos adversos raros. La vacuna ahora es usada ampliamente en todo el mundo, lo que significa que si surgiera una señal de seguridad deberían ser informados. La directora ejecutiva de la Agencia Europea de Medicamentos, Emer Cooke, afirmó el 20 de abril de 2021, que aún no se habían notificado coágulos en sangre tras la vacunación con Sputnik V.
El Centro Gamaleya informó el 12 de julio de 2021 que la vacuna Sputnik V, era eficaz contra las nuevas cepas de coronavirus, según sus estudios publicados en Vaccines. La vacunación produce títulos de anticuerpos neutralizantes contra las nuevas cepas, incluyendo alfa B.1.1.7 (identificada en Reino Unido), beta B.1.351 (identificada en Sudáfrica), gamma P.1 (identificada en Brasil), delta B.1.617.2 y B.1.617.3 (identificadas en India) y las variantes B.1.1.141 y B.1.1.317 (identificadas en Moscú). La metodología del estudio se basó en la evaluación de la actividad neutralizadora del virus mediante el uso de virus vivos, lo que permite obtener los datos más fiables. El estudio comparó la ANV del suero humano tras la vacunación con Sputnik V en muestras de las diferentes cepas frente a la cepa original B.1.1.1.
México En la campaña de vacunación de México, el 20 de marzo de 2021, el Ministerio de Salud aportó datos sobre la seguridad de las vacunas. Sputnik V fue la vacuna con menos efectos adversos graves registrados. El número de casos de sucesos adversos graves por cada 100 000 dosis fue de cero, con las otras vacunas disponibles osciló entre 0,8 y 2,5 por 100 000 dosis. Hasta el 5 de mayo, Sputnik V continuó mostrando el mejor perfil de seguridad entre los vacunados. Los casos de efectos adversos serios ascendieron a 0,5 por cada 100 000 dosis (con un total de 11 vacunados), con las otras vacunas disponibles también aumento a 1,18 y 2,06 por 100 000 dosis, sobre 1 900 000 dosis de Sputnik aplicadas.
Rusia En marzo de 2021 en Moscú, menos del 1 % había desarrollado la infección entre más de un millón de vacunados después de dos semanas de la vacunación y el 76 % de ellos fueron ligeramente o completamente asintomáticos. Según el Servicio Federal de Vigilancia Sanitaria ruso (Roszdravnadzor) hasta el día 9 de abril de 2021, Rusia no había detectado muertes vinculadas a las vacunas de producción nacional. De los casi 14 millones de ciudadanos rusos que se habían vacunado, 1,5 millones pueden supervisar su propio estado de salud mediante seguimiento en línea. Las autoridades no registraron ningún caso de trombosis después de la vacunación con Sputnik V. La directora del Servicio Federal de Vigilancia Sanitaria explicó que la purificación de la vacuna Sputnik V en varias etapas con el uso de cromatografía de alta tecnología (método de separación de mezclas complejas) y microfiltración excluía la infiltración en la vacuna de grandes cantidades de ADN residual que es un factor de riesgo para la aparición de trombosis. La Sputnik V tiene una cantidad muy baja de ácidos nucleicos, tan solo 1 o 2 microgramos, frente a los entre 50 y 100 microgramos presentes en otras vacunas contra el coronavirus. El centro Gamaleya, creador de Sputnik V, se mostraba dispuesto a compartir su tecnología de purificación con otros fabricantes de vacunas para ayudarles a minimizar los riesgos de efectos secundarios. Los especialistas rusos detallaron que la tecnología de purificación usada consta de cuatro etapas, dos de purificación con técnica cromatográfica y otras dos de filtración tangencial.
India El Ministerio de Salud de la India dijo el 13 de abril, que su regulador de medicamentos encontró que los datos de seguridad e inmunogenicidad en la campaña de vacunación fueron comparables a los de los ensayos clínicos.
Argentina El Ministerio de Salud de Argentina el 14 de abril informó de la ausencia de formación de coágulos de sangre como efecto secundario de la vacuna. El 24 de mayo la provincia de Buenos Aires, en su primer ensayo de seguridad fuera de Rusia, confirmó los datos ya que la mayoría de los eventos postvacunación fueron leves. No se registraron muertes relacionadas con la vacuna. La investigación vigiló la seguridad de la vacuna en 2,8 millones de bonaerenses que fueron vacunados entre finales de diciembre de 2020 y principios de junio de 2021. Los 'Eventos Supuestamente Atribuibles a la Vacunación o Inmunización' (ESAVI) fueron en su mayoría leves. Hubo 125 ESAVI graves, de ellos, solo seis se relacionaron directamente con Sputnik V, generando reacciones alérgicas de las que los vacunados se recuperaron por completo. La tasa de ESAVI grave relacionada al producto por millón de dosis aplicadas fue de 0,7. En comparación con diferentes vacunas aplicadas en el mismo período, tuvieron una tasa de ESAVI grave relacionada al producto por millón de dosis aplicadas de 0,8 y 3,2 respectivamente. Un prepublicación del Hospital Italiano de Buenos Aires en Argentina del 6 de julio de 2021, no informó casos de trastornos de la coagulación o eventos adversos de especial interés entre 683 trabajadores de la salud vacunados con Sputnik V. En julio de 2021, Argentina detalló los efectos adversos tras el uso de las vacunas utilizadas incluida la Sputnik V. El Ministerio de Salud del país informó que Sputnik V provocó 38 140 efectos adversos, de los que 548,73 por 100 000 fueron no graves y 2,78 por 100 000 fueron graves. Entre los vacunados con Sputnik V, el evento más común fue la cefalea (dolor de cabeza) con mialgias (15 278 casos), fiebre (1837), síndrome gastrointestinal con o sin fiebre (678) y alergia (634), entre otros. En particular los casos de eventos adversos graves que requirieron hospitalización fueron extremadamente raros (solo el 0,0027 %).
Hungría Según cifras oficiales de Hungría la vacuna Sputnik V es la más eficaz y segura de las cinco vacunas utilizadas en el país, primero en la UE en usarla. El gobierno húngaro liberó datos actualizados de infecciones y muertes entre los vacunados con las dos dosis a partir del 26 de diciembre de 2020 hasta el 20 de abril de 2021. Las estadísticas mostraron que 95 personas contrajeron COVID-19 y una persona por cada 100 000 murió de la enfermedad tras recibir las dos dosis de Sputnik V. Hungría registró entre 7 a 32 veces menos muertes entre las personas vacunadas con Sputnik V y de 2 a 7 veces menos el número de infecciones por cada 100 000 personas de entre aquellos inoculados con las otras vacunas disponibles. Estos datos fueron criticados por otros científicos que los consideraron muy alejados de otras estadísticas de seguridad y pidieron el acceso a los datos en bruto. Hay que señalar que las personas que vivían en residencias de ancianos fueron las primeras en vacunarse con las vacunas de menor incidencia de prevención de la mortalidad.
Serbia En mayo de 2021 la vacuna Sputnik V demostraba el mejor perfil de seguridad durante la campaña de vacunación en Serbia. No se registraron eventos adversos graves ni de muertes relacionadas con la vacunación. Tampoco se observaron casos de trombosis venosa cerebral, después de la vacunación.
Filipinas En mayo de 2021 el Departamento de Salud de Filipinas comunicó que no habían registrado ningún evento adverso grave o muertes con respecto a la vacuna Sputnik V.
San Marino Un estudio en la revista EclinicalMedicine del 10 de julio de 2021 mostró que la vacuna Sputnik V tiene un perfil de alta tolerabilidad en la población ≥ 60 años en términos de reacciones adversas a las vacunas a corto plazo después de ambas dosis. El estudio se basaba en la vacunación en San Marino desde el 4 de marzo al 8 de abril. La edad media de los 2 558 vacunados era de 66 años. La incidencia de los eventos adversos posteriores a la primera dosis fue del 53,3 % (reacciones sistémicas, en un 42,2 %), mientras que la incidencia tras la segunda dosis fue del 66,8 % (reacciones sistémicas, en un 50,4 %). En general, el 76 % de los inmunizados con la pauta completa notificaron algunos efectos adversos después de cualquiera de las dosis de la vacuna, y el 2,1 % sufrió reacciones graves. En personas de entre 60 y 89 años, los efectos adversos se notificaron en un 70 % de los casos, con un 53 % de los vacunados que describieron reacciones sistémicas y un 0,8 % que informaron de síntomas graves. Los síntomas más frecuentes fueron dolor local, decaimiento, cefalea y dolor articular. No se reportaron muertes ni hospitalizaciones. Una actualización posterior del estudio observacional anterior llamado ROCCA, publicó sus resultados el 20 de mayo de 2022. Concluyó que basados en un período de tres meses de seguimiento con el seguimiento de hasta 6 000 adultos, los resultados muestran una alta tolerabilidad y un buen perfil de seguridad de la Gam-COVID-Vac (Sputnik V) en el total de la población de San Marino, con un menor perfil de reactogenicidad en los adultos mayores que en los jóvenes adultos, en género masculino y en personas sin historial de alergias a los alimentos. Estos resultados corroboraron y ampliaron los resultados de la investigación preliminar. Los grupos citados son menos propensos a tener eventos sistémicos y locales de grado tres o cuatro después de dos vacunas. Ser mujer resultó en un riesgo seis veces mayor de sufrir eventos adversos más graves después de la primera dosis. Los académicos aún discuten la razón por la cual el sexo es un factor determinante de esta diferencia. En otros estudios de vigilancia de vacunas también se observó que las mujeres informaron síntomas con más frecuencia que los hombres. Previamente, se creía que hombres y mujeres respondían a Sputnik V de la misma manera. El director del Centro Gamaleya dijo en octubre de 2020 que con un número mayor de vacunados quizás se podría encontrar una diferencia estadísticamente creíble.
Eficacia y Eficiencia
Generalidades
Sputnik V es una de las tres vacunas del mundo con una eficacia superior al 90 %. Se determinó una eficacia de la vacuna del 91,6 % en ensayos clínicos de fase III. Cuando a una persona se le administra una vacuna con un vector viral, además de generar una respuesta inmune contra la proteína de pico del coronavirus, el sistema inmunológico también genera una respuesta contra el vector viral en sí. Esta respuesta inmune puede destruir parte de la dosis de refuerzo antes de que pueda tener efecto, al administrarse posteriormente. La vacuna Sputnik V utiliza dos adenovirus humanos diferentes, Ad26 y Ad5, para cada una de sus dos dosis de vacuna. Es menos probable que esta vacuna heteróloga (o híbrida), con diferentes vectores para las vacunas de cebado y refuerzo, genere una respuesta inmune contra el vector viral que luego interfiera con el otro. Por tanto, también es menos probable que la vacuna tenga una eficacia reducida.
Alexander Gintsburg, director del Centro que creó la vacuna Sputnik V, explicó que para una vacuna es muy importante y necesario generar células de memoria inmunológica (inmunidad de células T de larga duración) para ello es esencial usar 2 dosis. El 30 de marzo del 2020, cuando el mismo se puso la vacuna, junto a todo el equipo de investigación, observó una inmunidad especialmente alta, equivalente a la de un afectado de COVID-19 que ha pasado la enfermedad. Respecto a la duración de la inmunidad, no se observaron cambios en sus niveles de anticuerpos en sangre 8 meses más tarde. Según Naor Bar-Zeev y Tom Inglesby de la Universidad Johns Hopkins un punto fuerte de la vacuna es el umbral de neutralización y la amplia respuesta inmune. Se genera una respuesta inmune estable humoral y celular. Esto se logra mediante el uso de dos vectores diferentes que resuelven el problema que podría causar el posible efecto neutralizante de la segunda inyección. El profesor de microbiología médica, David Livermore de Reino Unido, llamó la atención sobre los resultados impresionantes que mostró Sputnik V, al ser la primera vacuna de vectores de adenovirus en lograr una eficacia mayor del 90 %. La vacuna Sputnik V, en febrero del 2021, era una de las únicas cuatro vacunas cuyos resultados de ensayos clínicos de fase III se habían publicado en las principales revistas médicas revisadas por pares.
Son varios los parámetros a tener en cuenta en la eficiencia de la vacuna Sputnik V. Los ensayos clínicos y los estudios en la vida real de las campañas de vacunación, demuestran que más del 98 % de los voluntarios vacunados desarrollaron una respuesta inmune humoral y una respuesta inmune celular del 100 %. El nivel de anticuerpos neutralizantes del virus en voluntarios vacunados con Sputnik V, fue de 1,3 a 1,5 veces mayor que en los pacientes que se recuperaron de COVID-19. La eficacia de la vacuna para personas de edad avanzada fue del 91,8 % y no difirió estadísticamente de la del grupo de personas de 18 a 60 años. La segunda dosis de la vacuna Sputnik V puede administrarse hasta tres meses después de la inoculación del primer componente frente a los 21 días estipulados inicialmente. Incrementar el plazo entre la inyección de la primera y la segunda dosis no influye en la intensidad de la respuesta inmune inducida y en algunos casos la aumenta y la prolonga. En marzo de 2021 se preveía iniciar estudios en pacientes oncológicos y en personas que padecen sida y para el verano empezaría el estudio de los efectos de Sputnik V en los niños. Respecto a la vacunación entre quienes ya han contraído el COVID-19, la inyección solo del primer componente de la vacuna ayudaría a fortalecer la inmunidad generada tras el contagio. Los títulos de anticuerpos que se alcanzan son bastante altos, como después de la vacunación en dos etapas.
Eficacia en ensayos clínicos
El director del Centro Nacional de Investigación de Epidemiología y Microbiología Gamaleya anunció el 28 de mayo de 2020, que se seguían detectando anticuerpos en los propios científicos que estaban desarrollando la vacuna y se vacunaron voluntariamente. El 4 de septiembre de 2020 se publican en The Lancet los resultados de la fase I y II de la vacuna Sputnik V: Seguridad e inmunogenicidad de una vacuna COVID-19 heteróloga de estímulo primario, a base de vectores rAd5 y rAd26 en dos formulaciones: dos estudios abiertos, no aleatorios de fase I y II de Rusia. Científicos rusos determinaron que la respuesta inmune de Sputnik V era suficiente contra cualquier concentración de coronavirus. Se publicó el 11 de noviembre de 2020 el primer análisis intermedio de datos del ensayo clínico de la vacuna de fase III. Estos datos preliminares, obtenidos en Rusia, muestran una eficiencia después de la aplicación de la vacuna Sputnik V de un 92 %. El cálculo se realizó basándose en la distribución de 20 casos de COVID-19, identificados en el grupo placebo y en el grupo vacunado.
El 24 de noviembre se publica el segundo análisis intermedio de los datos de los ensayos clínicos de fase III. Se mostró una eficacia del 91,4 % para la vacuna Sputnik V, 28 días después de la primera dosis; la eficacia de la vacuna es superior al 95 %, 42 días después de la primera dosis. El cálculo se basó en el análisis de datos sobre 18 794 voluntarios que recibieron tanto la primera como la segunda dosis de la vacuna Sputnik V o placebo en el segundo punto de control. A 12 de octubre de 2020 ninguno de los 2 000 voluntarios se contagió del coronavirus después de dos dosis de la vacuna Sputnik V.
El 2 de febrero de 2021 se publican en The Lancet los resultados de la fase III de la vacuna Sputnik V: Seguridad y eficacia de una vacuna de estímulo primario para la COVID-19 basada en vectores Ad26 y Ad5 heterólogos: un análisis interino de un ensayo controlado y aleatorizado de fase III en Rusia. En los análisis primarios se incluyen los datos de los 19 866 voluntarios seleccionados, de los que 4 902 integraban el grupo de placebo, y el resto los vacunados. Los resultados provisionales del ensayo de fase III de Gam-COVID-Vac muestran que la vacuna es 91,6 % eficaz contra COVID-19. Los resultados también mostraron que la vacuna fue 100 % (95 % CI 94,4–100) eficaz contra COVID-19 grave, aunque este fue un resultado secundario, por lo que los resultados son preliminares. Esta eficiencia aumenta hasta el 91,8 % entre el grupo de 2 144 voluntarios mayores de 60 años. La vacuna indujo fuertes respuestas inmunes humorales (n = 342) y celulares (n = 44) en todos los estratos de edad. En particular, hubo algunos que no respondieron en el grupo de la vacuna (seis de 342), posiblemente debido a la inmunosenescencia en las personas mayores, características individuales de la formación de una respuesta inmune o trastornos inmunológicos concomitantes. Al final del estudio, hubo 62 casos (1,3 %) confirmados de COVID-19 en el grupo de placebo y solo 16 en el grupo de la vacuna (0,1 %). Sputnik V demostró ser un 100 % efectiva para prevenir el desarrollo de casos graves. El 13 de marzo de 2021 los creadores de Sputnik V dijeron que la vacuna demostró la misma eficacia en todas las edades y esperan que proporcione inmunidad por más de 2 años. Este dato se basa en la experiencia previa con vacunas adenovirales. El director del Centro Gamaleya, detalló que se pensaba que la eficacia de la vacuna en personas mayores de 60 años sería menor, debido a que su sistema inmunitario ya no responde tan bien, pero que no había ocurrido nada parecido. Las personas mayores de 60, 70 y 80 años responden perfectamente a este medicamento.
Eficiencia en pacientes en tratamiento por cáncer En marzo de 2021 comenzaron los estudios de la Sputnik V en pacientes que padecen cáncer. La vacuna no tiene contraindicaciones médicas para su uso en pacientes con esa enfermedad salvo en los casos en que estén sometidos a quimioterapia y tomen medicamentos que inhiban la reproducción de las células.
El Ministerio de Salud ruso publicó en junio de 2022 unas directrices para el Procedimiento para la vacunación de la población adulta contra el COVID-19 que afirma que se producen anticuerpos específicos en un 90 % de pacientes con cáncer. Los resultados de varios estudios clínicos obtenidos indican un buen perfil de tolerabilidad de vacunación y efectos adversos similar a de las personas sanas. Existe una gran variabilidad en la cantidad de anticuerpos formados, aunque su nivel en pacientes con cáncer es más bajo que en individuos sanos vacunados. Se indica que se recomienda Sputnik V para prevención sin restricciones adicionales en todos los pacientes oncológicos que hayan completado el tratamiento inmunosupresor, independientemente del estadio inicial y forma de la enfermedad. Los pacientes que han recibido tratamiento contra el cáncer tienen un mayor riesgo de COVID-19 grave, lo que hace que la vacunación en este grupo sea una prioridad.
Estudios de eficiencia en campañas de vacunación
El 28 de febrero de 2021 Denis Logunov, subdirector del centro que desarrolló la vacuna, informó que la vacuna Sputnik V estaba mostrando fuertes signos de efectividad contra nuevas mutaciones de COVID-19. Se esperaba que los resultados del ensayo que prueba la eficacia de la revacunación, mostrasen un efecto positivo en la protección contra las cepas del virus incluidas las cepas del Reino Unido y Sudáfrica.
En Argentina el 12 de abril de 2021, el estudio del CONICET bajo la coordinación del Ministerio de Salud reveló que la vacuna Sputnik V produce una alta respuesta inmune aún con una sola dosis. El 94 % de las personas que recibieron una sola dosis de la vacuna a los 21 días produjeron anticuerpos específicos. Las personas previamente infectadas que recibieron solo una dosis producen cinco veces más anticuerpos que quienes no tienen antecedentes de COVID-19. Esto ocurre en el 96 % de las personas menores de 60 y en los mayores la tasa es del 89 %. La inmunización se eleva al 100 % después de la segunda aplicación, debido a que la infección previa genera memoria inmunológica.
En estudios realizados en Rusia durante la campaña de vacunación, los desarrolladores de Sputnik V, anuncian el 19 de abril de 2021, que su eficacia es del 97,6 %, basándose en datos de 3,8 millones de vacunados. Fueron vacunados con ambos componentes de Sputnik V desde el 5 de diciembre de 2020 al 31 de marzo de 2021. La tasa de infección a partir de los 35 días a partir de la fecha de la primera inyección fue de sólo el 0,27 %. Al mismo tiempo, la incidencia entre los no vacunados de la población adulta fue de 1,1 % para un período comparable. La directora del organismo sanitario ruso Rospotrebnadzor, Anna Popova, afirmó el 29 de abril que la vacuna Sputnik V garantizaba una inmunidad frente al COVID-19 de al menos 10-12 meses. Observaban que la inmunidad después de la vacunación se mantenía bastante tiempo y era bastante estable y que la inmunidad que se desarrolla tras la vacunación protegía contra todas las cepas de coronavirus hasta ese momento. En abril de 2021 el responsable de la creación de la vacuna dijo que la vacuna Sputnik V era eficaz contra la llamada cepa india del coronavirus (B1.617). En junio de 2021, en condiciones de laboratorio, la vacuna ante la variante india mostró eficacia aunque la disminución de eficacia epidémica es de 1,4 - 2,4 veces en comparación con el suero obtenido de las cepas de Wuhan. El 29 de junio de 2021 el RDIF comunicó que la vacuna Sputnik V es más eficiente contra la variante delta del coronavirus detectada por primera vez en la India, que cualquier otra vacuna que haya publicado resultados sobre esta cepa hasta ahora. El estudio del Centro Gamaleya ha sido enviado para su publicación en una revista internacional revisada por pares. La eficacia de Sputnik V contra la cepa Delta es de aproximadamente el 90 %, hay una leve disminución de 2,6 veces en la actividad del suero de la vacuna contra la variante india del virus, mientras que la disminución de esa actividad para las demás vacunas es de 3 a 5 veces.
El 20 de mayo de 2021 el infectólogo argentino Hugo Pizzi afirmó que en la inoculación con Sputnik V se evidenció que el día 14, después de la primera dosis, el 85,5 % del grupo de estudio tenía anticuerpos contra el virus y el día 42, después de recibir la segunda dosis, el 99,65 % tenía anticuerpos. La sorpresa del estudio fue la cantidad de anticuerpos que se generan incluso superiores a los aportados por los datos de los productores. El 24 de mayo de 2021, un nuevo estudio del Instituto de Virología de Argentina mostró que la vacuna Sputnik V es altamente efectiva contra la nueva variante de coronavirus de Manaos (Brasil). El estudio también mostró que el 99,65 % de los vacunados tenían anticuerpos IgG contra la COVID-19 después de la segunda inyección.
El 10 de junio en Baréin se comunicó que la vacuna Sputnik V muestra un 94,3 % de eficacia y un alto perfil de seguridad en un estudio en Baréin, realizado de acuerdo con las directrices de la OMS y con la participación de más de 5 000 personas.
En Emiratos Árabes Unidos el Ministerio de Salud confirmó el 29 de junio de 2021, que en un estudio del mundo real (del inglés real world data) entre los receptores de la vacuna en el país, la vacuna Sputnik V tiene una eficacia del 97,8 %. Se estudió la eficacia y seguridad entre más de 81 000 sujetos que habían recibido ambos componentes de Sputnik V. El análisis se basaba en datos recopilados hasta el 8 de junio de 2021 durante la campaña de vacunación. EAU había participado en los ensayos de fase III de la vacuna con 1 000 voluntarios.
Un estudio de abril de 2022, en prepublicación y sin revisar por pares, estimó la efectividad del programa de vacunación en México con las diferentes vacunas en uso. Se evaluó la efectividad de las vacunas BNT162b2 (Cominarty de BioNtech-Pfizer), mRNA-12732 (Spikevax de Moderna), Gam-COVID-Vac (Sputnik V), Ad5-nCoV (Convidecia), Ad26.COV2.S (de Janssen), ChAdOx1 (Covishield de AstraZeneca-Oxford) y CoronaVac (Sinovac). Se valoró la protección a la infección, hospitalización y muerte relacionadas con COVID-19 para adultos ≥18 años. Se evaluaron 793 487 vacunados en comparación con 4 792 338 adultos no vacunados entre el 24 de diciembre de 2020 y el 27 de septiembre de 2021. Las tres vacunas con la efectividad más alta para las personas completamente vacunadas fueron: contra la infección: mRNA-12732: 91,45 %, Ad26.COV2.S: 82,18 % y ChAdOx1 80,79 %. contra la hospitalización: BNT162b2: 84,3 %, Gam-COVID-Vac: 81,4 % y ChAdOx1 80,23 %. contra la mortalidad: mRNA-12732: 93.46 %, BNT162b2: 89.83 %, y Gam-COVID-Vac: 87,7 %. Todas las vacunas fueron efectivas contra la infección, la hospitalización y muerte relacionadas con COVID-19. Este fue el primer informe que evaluaba simultáneamente la eficacia de siete vacunas diferentes y uno de los primeros informes basados en la población sobre la eficacia de las vacunas Gam-COVID-Vac (Sputnik V) y Ad5-nCoV (Convidecia).
En unos estudios realizados en julio de 2022 en Irán, la vacuna Sputnik V proporcionó una mejor protección contra el coronavirus. El estudio se basó en el análisis de datos de 3 591 estudiantes que fueron completamente vacunados con tres vacunas distintas, entre ellas Sputnik V, entre marzo y agosto de 2021. Según los resultados, Sputnik V mostró los mejores resultados en la protección contra la infección por coronavirus después de la vacunación: la proporción de participantes infectados con coronavirus fue de 3,13 % del total de vacunados con Sputnik V. En el resto de vacunados con otras dos vacunas tuvieron un PCR positivo entre 4,23 % y 6,22 %. Se detectó una tasa de infección confirmada por PCR de 4,51 % y sospechosa del 7,02 %. No hubo una relación significativa entre la infección recurrente y el género, el IMC, los grupos sanguíneos y las comorbilidades. Sin embargo, hubo una diferencia significativa en la tasa de avance de la infección entre los diferentes tipos de vacunas y el historial de infección por COVID-19. Un total de 16 participantes fueron hospitalizados por infección por COVID-19 y no se observó infección grave ni muerte en la población estudiada. La publicación aún no ha sido revisada por pares.
En un posterior estudio publicado por científicos iraníes el 26 de julio de 2022 se mostraron los resultados de análisis de personas inoculadas con alguna de las cuatro vacunas utilizadas en el país, incluyendo Sputnik V. Ninguna de ellas era de tecnología ARNm. La vacuna Sputnik V demostró una alta eficiencia produciendo un gran número de anticuerpos. Los investigadores se basaron en el análisis de datos de 174 voluntarios con una mediana de edad de 40 años. Sputnik V resultó ser la más eficaz entre las utilizadas. El estudio evaluó la respuesta de anticuerpos después de la segunda dosis de la vacuna entre trabajadores sanitarios, en muestras de sangre recolectadas al menos diez días después de la vacunación. Este estudio evaluó todos los anticuerpos empleando métodos ELISA. La proporción de hombres fue del 31 % y la frecuencia de infección de los que pasaron COVID-19 fue de 66 (38 %). El 58 % de los participantes recibieron Sputnik V. En los dos test de ensayos de la respuesta inmune fueron positivos en 37 (21 %) y 163 (94 %) participantes y su nivel medio fue mayor en las vacunas con vectores adenovirales. En conclusión, Oxford/AstraZeneca y Sputnik V tuvieron un resultado similar de inducción de altos niveles de anticuerpos neutralizantes y anti-SARS-Cov-2 mayores que en otras vacunas.
El 26 de octubre de 2022 fue publicado un estudio de investigación en la revista Vaccines acerca de la eficacia del uso de las vacunas Sputnik V y Sputnik Light para proteger del COVID-19 a trabajadores de la salud en un gran centro médico en Moscú. La preocupación era conocer el impacto de nuevas variantes del virus. Los investigadores rusos, entre ellos los diseñadores de estas vacunas ensayadas, han investigado la eficacia de Sputnik V y Sputnik Light a partir de los datos recibidos en el período de la dominación de la variante delta. Analizaron los datos de 1287 profesionales de la salud, vacunados con ambas vacunas. Los resultados del estudio demuestran que la eficacia epidemiológica general de la vacuna fue del 81,7 % (73.1–87.6 %) durante el período de la variante delta. Durante el periodo de observación completo, desde el 26 de noviembre de 2020 hasta el 8 de febrero de 2022, la eficacia global de la vacuna fue de 89,1 % (86.9–91.0 %). Como era de esperar, la mayor eficacia durante este período se obtuvo en el grupo que recibió la tercera y cuarta dosis con 96.5 % (75.0–99.5 %). La gravedad de COVID-19 en el grupo vacunado fue significativamente inferior en el grupo de los no vacunados.
En noviembre de 2022, científicos libios publicaron un estudio retrospectivo multicéntrico de tres vacunas: ChAdOx1 (AstraZeneca), CoronaVac y el primer componente de la vacuna rusa Sputnik V (Gam-COVID-Vac) en pacientes en Libia que habían recibido solo la primera dosis de las vacunas autorizadas. De abril a julio de 2021, se administraron en Libia 445 000 dosis únicas de la vacuna y se infectaron durante este período 39 996 personas. Entre las personas que no recibieron ninguna vacuna, el número de infectados fue 7,94 % y fallecieron el 7,10 %, frente al 0,10 % de los ingresados que habían tomado una dosis única de alguna de las vacunas autorizadas, de los cuales el 0,02 % (8 pacientes) fallecieron en ese período. De los pacientes documentados que ingresaron en los centros de salud se habían vacunado: 23 con la vacuna CoronaVac (Sinovac), 14 pacientes recibieron Oxford/AstraZeneca y 2 pacientes recibieron la vacuna Sputnik V. De los casos revisados de infección irruptiva (receptores de vacuna COVID-19 que contrajeron el virus después de haber sido completamente vacunados), 8 fallecieron. No se informó de muertes debido a infección avanzada entre los pacientes vacunados con Sputnik V. Una dosis única de los tres tipos de la vacuna redujo significativamente la transmisión y la disminución en la tasa de mortalidad. Estos resultados se obtuvieron antes de que la variante delta u ómicron entraran en Libia. Una sola dosis del componente primero de la Vacuna Sputnik V es equivalente a la vacuna Sputnik Light monodosis, por lo que los resultados podrían ser aplicables. La primera dosis de Sputnik V tuvo el mejor cumplimiento, ya que todas las personas vacunadas con ella tuvieron las tasas de hospitalización más bajas y cero muertes por COVID-19 después de la reinfección.
El 15 de noviembre de 2022 en un estudio realizado por científicos de Rusia y Austria y publicados en la revista NPJ Vaccines se concluyó que la vacunación con Sputnik V forma una inmunidad fuerte y estable al coronavirus, que persiste durante varios meses. La formación de anticuerpos contra el adenovirus humano Ad26 que normalmente se generan con el primer componente de Sputnik V, no afecta la respuesta inmunitaria humoral por la vacunación de refuerzo con Sputnik Light que también se basa en Ad26. La vacunación con Sputnik V estimuló la producción de anticuerpos neutralizantes que permanecieron en la sangre durante al menos nueve meses. Los niveles de anticuerpos IgG específicos neutralizaron tanto la cepa original como las variantes delta y ómicron y no dependieron de los niveles de anticuerpos neutralizantes de Ad26. Los indicadores de anticuerpos neutralizantes permitieron concluir que el momento óptimo para una dosis de refuerzo es el período de 6 a 9 meses después de la vacunación primaria con dos componentes de Sputnik V. El estudio está revisado por pares y la publicación pertenece al grupo Nature.
Un artículo publicado en Vaccine el 21 de noviembre de 2022, confirmó una alta protección a largo plazo con Sputnik V. El estudio fue realizado por el equipo de la Universidad Nacional de San Luis en Argentina, con vacunas en uso y combinaciones de ellas. Participaron 376 estudiantes y profesores voluntarios de entre 20 y 70 años que fueron vacunados con al menos una inyección. Los voluntarios incluían a los que habían estado o no enfermos de coronavirus. Se analizaron muestras de sangre a los 20, 40, 80, 120 y 180 días después de la primera inyección, entre julio y diciembre de 2021. Según el estudio, la vacuna Sputnik V en el período entre 120 y 180 días después de la primera inyección, obtuvo el nivel de anticuerpos IgG más alto que en otras vacunas, excepto en la combinación heteróloga. Se detectaron anticuerpos en 350 de los 376 voluntarios que recibieron al menos una dosis de la vacuna más de 20 días después, con un valor promedio de seroprevalencia del 93,34 %. En general, el 84,5 % de los que recibieron Sinopharm, el 100 % de los participantes que recibieron ChAdOx1 (AstraZeneca), el 98 % con Sputnik V y el 98 % de los participantes con la vacunación combinada. Esto confirma los hallazgos de estudios previos e informes de trabajadores de la salud de Argentina vacunados con Sputnik V.
Un estudio publicado en Vaccines el 30 de diciembre de 2022 por científicos rusos confirmó la protección a largo plazo con Sputnik V y también la alta inmunogenicidad cuando se revacuna, independientemente de la edad de los vacunados. Se realizó este estudio con 3983 muestras obtenidas de individuos previamente vacunados con Sputnik. El análisis de muestras de los participantes antes de la vacunación demostró que el 95,5 % de los pacientes mantenían una respuesta IgG al dominio de unión al receptor (RBD) del SARS-CoV-2 seis meses después de la vacunación inicial. Una inyección de refuerzo de incluso Sputnik Light es suficiente para mantener una inmunidad fuerte en la mayoría de los vacunados previamente, independientemente de su edad y de los niveles de anticuerpos previos a la revacunación. Sin embargo, la medida en que aumentan los niveles de anticuerpos tras la revacunación depende de los niveles de partida anteriores a la revacunación. La revacunación es más eficaz en las personas con un nivel previo de anticuerpos inferior a 500 BAU/mL.
Inmunización de Sputnik V frente a la variante ómicron En noviembre de 2021, apareció la primera información sobre una nueva variante del virus SARS-CoV-2, que recibió el nombre de ómicron. Esta variante es preocupante porque contiene una gran cantidad de mutaciones que podrían reducir significativamente la efectividad de las vacunas COVID-19. En diciembre de 2021 se realizó un estudio de anticuerpos neutralizantes en el suero sanguíneo de personas vacunadas con Sputnik V y también revacunadas con Sputnik Light después de Sputnik V. Los resultados mostraron una disminución en el nivel de anticuerpos neutralizantes contra la variante SARS-CoV-2 ómicron (B.1.1.529) en comparación con la variante B.1.1.1. Se vio en el análisis de los sueros de individuos vacunados con Sputnik V hace 6-12 meses, que hubo una disminución en el nivel de anticuerpos neutralizantes de 11,76 veces. Si bien en este estudio no se realizó una comparación directa con las disminuciones de otras vacunas, existe una neutralización de anticuerpos a un nivel mucho más significativo de 40 a 84 veces. Los vacunados con Sputnik V y luego revacunados con Sputnik Light a los 2-3 meses después de la revacunación la disminución en el nivel de anticuerpos neutralizantes contra la variante ómicron fue de 7,13 veces.
Un estudio científico suizo publicado en Nature, determinó la capacidad de neutralización del virus ómicron mediante el plasma de individuos vacunados respecto a la variante original Wuhan. Se comparó la capacidad neutralizante entre individuos convalecientes y plasma de vacunados con seis vacunas distintas: dos de ARNm, tres de adenovirus y una de virus inactivado. Las personas convalecientes y las personas que habían sido vacunadas con las vacunas de adenovirus incluida la Sputnik V y la de virus atenuado no tuvieron actividad neutralizante detectable contra ómicron. Los individuos que fueron inmunizados con vacunas de ARNm y una de adenovirus tuvieron una mayor actividad neutralizante contra Wuhan-Hu-1 y mantuvieron la actividad contra ómicron, con disminuciones de 33, 44 y 36 veces respecto a la primera. Esta disminución fue cinco veces menos pronunciada para los individuos vacunados que estaban previamente infectados. Las muestras de suero de vacunados con Sputnik V fueron obtenidas de trabajadores de la salud del Hospital de Clínicas José de San Martín en Buenos Aires.
El 20 de enero de 2022 un estudio comparativo independiente, realizado en el Instituto Nacional de Enfermedades Infecciosas Lazzaro Spallanzani (Italia) por un equipo de investigadores del Instituto italiano y del Centro Gamaleya mostraron que dos dosis de Sputnik V proporcionan más de dos veces más títulos medios geométricos de anticuerpos neutralizantes de virus para la variante ómicron que dos dosis de otra conocida vacuna (2,1 veces mayor en total y 2,6 veces mayor 3 meses después de la vacunación). El trabajo fue publicado el 15 de enero de 2022. En este estudio se demostró la disminución de la actividad neutralizante de los sueros frente a la variante ómicron (B.1.1.529) frente a la variante de referencia Wuhan D614G (B.1) en individuos vacunados con 2 dosis de Sputnik V y otra vacuna de ARNm hasta 6 meses después de la vacunación. La disminución del anticuerpo neutralizante contra la variante ómicron fue de 8,1 veces para vacunados con Sputnik V y de 21,4 veces para vacunados con la otra vacuna. El 74,2 % de los sueros vacunados con Sputnik V y el 56,9 % de los sueros vacunados con otra vacuna tenían anticuerpos neutralizantes detectables contra la variante ómicron. La disminución de estos anticuerpos a la variante ómicron en comparación con la variante de Wuhan se ha visto en muchas vacunas en uso, incluso algunas no muestran neutralización alguna. Otras conclusiones son que la vacunación de refuerzo con la variante monodosis Sputnik Light ha demostrado ser una de las mejores soluciones para prolongar el periodo de protección de otras vacunas. Sputnik V desarrolla un conjunto más amplio de anticuerpos contra diferentes epítopos, en contraste con otras vacunas, que utilizan la proteína de la espiga en forma estabilizada por prolina, afectando principalmente a epítopos específicos muy distorsionados por las mutaciones de la cepa ómicron.
Según un estudio conjunto publicado en junio de 2022 en Rusia por el Hospital Clínico de Moscú n.º 67 y el Centro Gamaleya, se determinó la efectividad de Sputnik V cuando se potencia con Sputnik Light o se revacuna con Sputnik V con la cepa ómicron. Los científicos analizaron datos de más de 1000 pacientes entre el 11 de enero y el 21 de febrero de 2022. La efectividad de Sputnik V después de la vacunación con al menos una dosis fue del 85,9 % contra todo tipo de hospitalización. Al potenciar con la tercera y cuarta dosis (Sputnik Light o revacunación con Sputnik V), la efectividad fue de 97 % contra todo tipo de hospitalización, 97,7 %, contra casos moderados y severos, 98,6 % contra casos severos y críticos y 99.4 % contra casos críticos.
A mediados de junio de 2022 el director del Centro Gamaleya informó que se recomendaría la vacunación intranasal adicional contra una nueva subvariante de la cepa ómicron BA.4 en caso de protección insuficiente de los ya vacunados con Sputnik V. Se esperaba obtener las cepas de las subvariantes para estudiar la protección de los vacunados y, si era necesario, recomendar la vacuna intranasal aunque en ese momento había un problema de disponibilidad de boquillas para la vacunación masiva. A pesar de conocerse la secuencia de nucleótidos de la cepa, quedaba por ver cómo sería neutralizada por el suero de pacientes que habían sido vacunados con Sputnik V.
Un estudio comparativo de vacunas para COVID-19 realizado en México y publicado en junio de 2022 muestra nuevos datos discrepantes. Se estudiaron los niveles de anticuerpos producidos por cinco distintas vacunas en poblaciones con altas incidencias de SARS-CoV-2. La mayoría de los receptores tenían una actividad neutralizante indetectable contra la reciente variante ómicron. La infección por SARS-CoV-2, experimentada antes o después de la vacunación, potenció las respuestas inmunitarias de las células B y permitió la generación de actividad neutralizante contra ómicron para todas las vacunas en casi todos los individuos. Se recoge también la evidencia de evasividad inmunológica que se ha propagado en la población mexicana con la reciente aparición de B.1.1.529 (ómicron). Los estudios comparativos directos de inmunidad de vacunas para el COVID-19 son escasos en países con menos recursos, ya que la mayoría se han centrado en vacunas individuales correspondientes a las distribuidas en países de ingresos altos. El ensayo se realizó durante el período comprendido entre el invierno de 2020 y la primavera de 2021 con muestras de sangre de 197 individuos. El 40,6 % de los participantes se habían infectado con SARS-CoV-2 previamente. Las variantes B.1 y B.1.1.159 fueron las más prevalentes en los diagnósticos de PCR. Los datos revelaron diferencias importantes en la capacidad de las vacunas para provocar anticuerpos neutralizantes y memoria de células B tanto en individuos sin tratamiento previo como previamente infectados y contra múltiples variantes. Las vacunas ChAdOx1-S, Sputnik V, Ad5-nCoV y CoronaVac tenían capacidades variables para generar anticuerpos neutralizantes, y todas generaron títulos más bajos que los provocados por la BNT162b2 contra todas las variantes. Por lo que se esperaba que mostrasen niveles más bajos de protección contra la infección. La mayoría de los receptores de vacunas no infectados previamente carecían de actividad neutralizante detectable contra ómicron por lo que era poco probable que estuvieran protegidos contra la infección. Sin embargo Sputnik V consiguió la respuesta más alta de anticuerpos de todas las vacunas entre personas vacunadas y previamente infectadas con COVID-19.
En julio de 2022 científicos de la Universidad Europea de San Petersburgo y el Instituto Médico Sergey Berezin evaluaron comparativamente la eficacia de vacunas COVID-19. Usaron datos de pacientes con PCR positivo a los que se hizo una tomografía computarizada de los pulmones. Aunque la vacuna Sputnik V tuvo el mayor efecto protector contra el coronavirus, el director del Centro Gamaleya opinó que era incorrecto comparar vacunas de tecnologías diferentes. Sputnik V debe compararse con vacunas de ARN, lo que ya hizo el Instituto Spallanzani. En la ausencia actual de recomendaciones internacionales y rusas para cambiar de una preparación de vacuna a otra cuando cambia la cepa del virus sería necesario usar una vacuna nasal en forma de refuerzo. Esto daría una protección del 90-95 % contra el coronavirus.
El 25 de julio de 2022 el director del Instituto de Virología del Centro Federal de Investigación de Medicina Fundamental y Traslacional, Alexander Shestopalov, compartió la opinión de que la vacuna Sputnik V protegerá eficazmente contra una subvariante de la cepa ómicron del coronavirus, la BA.2.75, conocida como centauro. Ya se han registrado casos de infección por esta subvariante de la cepa ómicron del coronavirus en más de 10 países. El 19 de julio cinco personas estaban infectadas en Rusia. Shestopalov dijo que la vacuna Sputnik V se dirige a partes conservadoras del virus que con gran dificultad rara vez cambian y así protege contra todas las variantes del coronavirus. No hay necesidad de cambiar la vacuna. Según Shestopalov, la infección por coronavirus ya se está convirtiendo en una enfermedad estacional que, como la gripe, requiere control virológico.
Estimaciones de permanencia de la inmunización en vacunados Datos obtenidos de la campaña de vacunación en San Marino por el Ministerio de Salud sobre la vacuna Sputnik V, demostraron que tenía una efectividad del 80 % contra la infección por coronavirus del sexto al octavo mes después de la administración de la segunda dosis. La eficacia de Sputnik V en 6-8 meses es mucho mayor que la eficacia publicada oficialmente de las vacunas de ARNm. Los datos se basaban en la cantidad de infecciones por COVID-19 en San Marino en noviembre de 2021. La eficacia se calculó basándose en los datos obtenidos de más de 18 600 personas que recibieron la vacuna completa con Sputnik V no menos de 5 meses antes de noviembre.
Investigaciones llevadas a cabo en enero de 2022 comprobaron que el nivel de anticuerpos de Sputnik V se mantiene después de 6 meses de la vacunación. El Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) de Argentina observó que aunque tras ese período los anticuerpos totales disminuyen, la capacidad de aquellos anticuerpos que neutralizan diferentes variantes del SARS CoV-2 se sostiene. El estudio se basa en el análisis de 1 800 muestras serológicas. Esto se debe a que los anticuerpos atraviesan un proceso de maduración y van mejorando su calidad en los primeros meses después de aplicada la vacuna. El estudio se realizó en forma paralela con otras investigaciones centradas en el tipo de respuesta inmune que generan otras vacunas de las que aún se estaban analizando los resultados. Si bien la cantidad de anticuerpos generados tras la vacunación descienden unas diez veces después de los seis meses de su aplicación, la capacidad neutralizante se mantiene constante durante cuatro meses y muestra solo una leve disminución a los seis meses. Sputnik V neutraliza eficientemente a las variantes alfa, delta y lambda. También se observó que la capacidad neutralizante de Sputnik V contra las variantes beta (Sudáfrica) y gamma (Manaos) se incrementa con el tiempo.
En febrero de 2022 voluntarios inoculados con Sputnik V en Moscú continúan con altos niveles de anticuerpos un año después. Una investigación adicional de la vacuna con 3 000 voluntarios que recibieron dos dosis de la vacuna. Los participantes realizaron una analítica de sangre para evaluar la capacidad de producir anticuerpos contra el virus. Los resultados de 1 323 participantes del total mostraron que el 80 % de ellos todavía tenía un nivel de anticuerpos por encima de 200 BAU ('Binding antibody Unit'), lo que se considera un índice bastante alto. En los resultados preliminares del nivel de anticuerpos se observó la presencia de niveles suficientemente altos de anticuerpos IgG específicos contra el coronavirus de la proteína S.
En un estudio de investigación publicado en International Journal of Infectious Diseases en junio de 2022 y llevado a cabo en Venezuela se observó la respuesta inmune después de la vacunación con Sputnik V en individuos vacunados y con infección previa de la enfermedad y otros solo con inmunidad inducida por la vacunación. Los datos representan un seguimiento de 6 meses sobre 86 trabajadores: 32 con infección previa por COVID-19 y 54 sin haber sufrido la enfermedad antes de las dos dosis de refuerzo. Se midieron los niveles de anticuerpos el día 42 y el día 180. Los niveles disminuyeron aproximadamente un 50 % en el periodo de 42 días sin enfermedad previa con COVID-19 (GTM 675 BAU/mL frente a 327 BAU/mL) y disminuyeron aproximadamente un 25 % en la cohorte previamente infectada (GMT 1209 BAU/mL frente a 910 BAU/mL). El 94 % mostró una actividad neutralizante de buena a excelente medida 6 meses después de la vacunación. Se concluyó que la vacuna Sputnik V proporcionó inmunidad humoral duradera y a largo plazo, especialmente si una persona había sido vacunada y tenía una infección previa con SARS-CoV-2. Los niveles de IgG 6 meses después de la vacunación en la mayoría de los sujetos sin enfermedad previa se mantuvieron por encima de 100 BAU/mL. Además, 19 (40 %) de los participantes sin experiencia previa con COVID-19 en este estudio tenían anticuerpos IgG-RBD por encima del nivel de 400 BAU/mL. Después de 6 meses, todos los sujetos previamente infectados con COVID-19 tenían anticuerpos IgG-RBD por encima de ese mismo nivel. En este estudio se citan comparativamente otros estudios realizados en Estonia, EE.UU. e Israel donde los descensos de los títulos de anticuerpos después de 6 meses con otras vacunas distintas contra el SARS-Cov-2 son significativamente bastante más pronunciados. En otra investigación similar, realizada en Argentina, se mostraron datos con un mayor descenso para los que no habían pasado la enfermedad. En otro de los estudios también en Argentina, con una cohorte de 118 voluntarios, se evaluó la respuesta humoral durante 6 meses después de la vacunación con Sputnik V mostrando que la potencia neutralizante de los anticuerpos se mantuvo para todas las variantes del SARS-CoV-2 analizadas.
Investigadores de Serbia compararon tres vacunas utilizadas en el país, entre las cuales estaba Sputnik V. El título de anticuerpos después de la vacunación con Sputnik V fue mejor sostenido que el de las otras vacunas después de seis meses de la inoculación. Los científicos analizaron los datos de 231 serbios de 20 años o más, que no habían estado enfermos de coronavirus y habían sido vacunados con dos dosis de una de las tres vacunas en el período de enero a junio de 2021. Los investigadores compararon los títulos de anticuerpos IgG pasados 28 días y 6 meses después de la vacunación y demostraron que la vacuna Sputnik V proporcionaba la menor caída de los niveles de anticuerpos con el tiempo entre todos los medicamentos. Esto demostró la alta eficacia de la vacuna, pero la reducción de la cantidad de anticuerpos también dejó ver la necesidad de una vacuna de refuerzo. Fue publicado en SSRN, plataforma de investigación de acceso abierto de investigaciones en etapa inicial, el 19 de octubre de 2022.
Eficacia de la vacuna en pacientes con VIH La vacuna Sputnik V, ha demostrado eficacia en pacientes con VIH positivo que reciben terapia antirretroviral, según un estudio publicado en la revista The Lancet el 23 de marzo de 2022. Los autores señalaron que la inmunización completa con la vacuna implicó una reducción de 3,29 veces el número de infecciones por el coronavirus en comparación con los no vacunados. Mientras, en los pacientes con una función inmunológica comprometida, la vacunación redujo el riesgo de COVID-19 en 2,5 veces. El estudio financiado por el Ministerio de Salud de Rusia y el Departamento de Salud de Moscú se llevó a cabo para evaluar la eficacia de la vacunación estándar con Sputnik V en 24 423 residentes de Moscú con VIH, entre abril y septiembre de 2021. Los participantes incluían la variante delta y se valoraron las tasas de hospitalización y enfermedades graves en pacientes vacunados y no vacunados. El VIH daña el sistema inmunitario, los pacientes con VIH que tienen un recuento de linfocitos CD4 inferior a 200 corren un alto riesgo de desarrollar enfermedades graves. La eficiencia epidemiológica de Sputnik V en toda la cohorte de personas VIH positivas en terapia antirretroviral fue del 76,33 % y en VIH+ con CD4+ ≥350 células/µL la eficiencia de la vacuna fue del 79,42 %, evitando la hospitalización en el 90,12 % de los casos y protegiendo del desarrollo de enfermedad moderada o severa en 97,06 %. Para la variante delta en este grupo la eficacia fue del 65,35 %, evitando la necesidad de hospitalización en el 75,77 % de los casos y protegiendo del desarrollo de enfermedad moderada o grave en el 93,05 % de los pacientes. Se sugirió la eficiencia epidemiológica de la inmunización con Sputnik V en pacientes VIH positivos y tratados con terapia antirretroviral para las variantes original y delta del SARS-CoV-2.
Deficiencias inmunización a variante sudafricana Según un estudio de abril de 2021 una variante del virus SARS-CoV-2 detectada en Sudáfrica puede evadir los anticuerpos provocados por la vacuna Sputnik V contra la COVID-19. Científicos de la Escuela de Medicina Icahn en Nueva York obtuvieron muestras de suero sanguíneo con de anticuerpos de 12 personas vacunadas con Sputnik V. Los autores probaron el suero contra virus benignos diseñados para hacer las versiones de pico que se encuentran en ciertas variantes del SARS-CoV-2. Ocho de las 12 muestras no inhibieron los virus equipados con picos de B.1.351, la variante identificada en Sudáfrica. Pero las muestras superaron con eficacia los virus con pico de la variante B.1.1.7, que se detectó en Gran Bretaña. Los hallazgos aún no han sido revisados por pares.
Producción
Tecnología de fabricación
La Gam-COVID-Vac o Sputnik V es una vacuna de vector viral basada en el adenovirus humano, un virus del resfriado común, fusionado con la proteína de espiga del SARS-CoV-2 para estimular una respuesta inmunitaria. Consta de dos componentes distintos en los que se utilizan los serotipos de adenovirus Ad5 y Ad26. No se usa un fragmento de activador de plasminógeno de tipo tisular y el inserto de antígeno es una proteína S de longitud completa sin modificar. La Sputnik V se produce con la línea celular HEK293, que se utiliza de forma segura desde hace mucho tiempo para la producción de otros productos biotecnológicos. Utiliza una tecnología de purificación de 4 etapas que incluye dos etapas de cromatografía y dos de filtración de flujo tangencial. Esta tecnología ayuda a obtener un producto altamente purificado que pasa por un control obligatorio que incluye el análisis de la presencia de ADN libre. La tecnología utilizada para su desarrollo no es exclusiva y en otros países también es utilizada por investigadores. Sputnik V pertenece al grupo de las vacunas vectoriales. La vacuna se creó en cinco meses, desde la fecha de recepción de la orden estatal hasta el momento del registro.
Fabricación y países productores
En abril de 2021 los responsables de Sputnik V anunciaron que más de 20 empresas en 13 países producirían suficientes vacunas para suministrar a 800 millones de personas al año. En julio los acuerdos de producción de Sputnik V alcanzaron los 15 países. Los mayores fabricantes extranjeros de la vacuna serían India e Irán. En septiembre se habían producido y utilizado más de 150 millones de dosis de la vacuna en Rusia y en otros países del mundo, según el subdirector del Centro Gamaleya y desarrollador principal de Sputnik V, Denis Logunov. El lanzamiento de la producción en masa de ambas vacunas, Sputnik V y Sputnik Light, se completó en octubre de 2021, lo que garantizó un suministro estable de grandes volúmenes desde 25 sitios de producción en 15 países, incluidos Rusia, India, Corea del Sur y otros.
En el segundo aniversario de la vacuna, el 11 de agosto de 2022, más de 500 millones de personas ya habían sido vacunadas con Sputnik V. Se generaron más de 50 estudios clínicos que han sido publicados en las principales revistas médicas internacionales revisadas por pares. La vacuna Sputnik V fue el fármaco más exportado en la historia de Rusia. Los problemas de suministro por la alta demanda y la demora en la producción externa impidieron que, en general, el RDIF no pudiera suministrar los 896 millones de dosis de Sputnik V en el extranjero que planeaba para el 2021. Se estima que hasta julio de 2021, Rusia había suministrado unos 17 millones de dosis de Sputnik V a otros países, o solo el 1,9 % de lo planeado. Debido a que la información sobre los contratos y suministros de la vacuna en el extranjero no ha estado disponible públicamente, los datos pueden ser inexactos. Se esperaba cumplir los compromisos, priorizando la demanda interna de Rusia, y poder liberar capacidad de producción para importación. En esa fecha se habían administrado unos 51 millones de inyecciones de Sputnik V en Rusia. Ante la polémica surgida a nivel mundial de eliminar la protección de patente de las vacunas, Rusia estuvo dispuesta a apoyar la idea para que pudieran ser utilizadas en todo el mundo. Era el único país del mundo que cedía a otras naciones la tecnología para la producción de sus vacunas. Esa práctica ya se estaba implementando en algunos países donde había producción de Sputnik V con la transferencia tecnológica. Esta opción de vender licencias de su vacuna para la producción en el extranjero, evitaba la construcción de más fábricas en el país de origen y se simplificaba la logística.
Los países que producen localmente la vacuna son:
| PAÍS | PRODUCCIÓN PLANEADA Y FECHA ACUERDOS
(en millones de dosis) |
EMPRESAS
PRODUCTORAS |
FECHA INICIO PRODUCCIÓN |
|---|---|---|---|
| Argentina | 9 (total, fin producción) en 9-2022 | Laboratorios Richmond | 20-4-2021 lote de prueba 4-6-2021 producción comercial |
| Bielorrusia | hasta 0,5 (al mes) en 1-2022 | 25-3-2021 | |
| Brasil | 8 (al mes) en 1-2022 | Bthek Biotecnologia, União Química | 1-2021 lote de prueba 20-5-2021 primer lote comercial |
| Corea del Sur | 1850 (al año) en 2021 | 150 GL Rapha, 500 consorcio de GL Rapha, ISU ABXIS, Jetema y Handkook Korus Pharm y 100 (al mes) consorcio encabezado por Huons Global. | fin 12-2020 lotes de prueba 5-2021 producción comercial |
| India | entre 850 y 1152 (al año) en 2021 | Hetero Biopharma, Virchow Biotech, Stelis Biopharma, Gland Pharma, Panacea Biotec, Serum Institute of India, Morepen Laboratories, y Shilpa Medicare. |
6-7-2021 lote de prueba
8 a 10-2021 producción comercial |
| Irán | 30-1-2021 | 26-6-2021 lote de prueba | |
| Kazajistán | 8,5 en 2022 | Karaganda Pharmaceutical Complex | 12-2020 lote de prueba 27-1-2021 producción comercial |
| Rusia | 266,4 en 1-2022 | Medgamal (Centro Gamaleya), Binnopharm Group, Generium Pharmaceuticals, Biocad, R-Pharm | 15-08-2020 |
| Serbia | 4 en 12-2021 | Instituto Torlak | 14-4-2021 lote de prueba 4-6-2021 producción comercial |
| Uzbekistán | 2 (al año) en 2021 | Jurabek Laboratories | 30-7-2021 lote de prueba 7-10-2021 producción comercial |
| Vietnam | 30-40 en 2022 | Vabiotech y T&T Group | 21-7-2021 lote de prueba |
Además de estos países con centros de producción que efectivamente manufacturaron dosis de la vacuna para exportación o consumo interno, otros países también planearon la fabricación local en fábricas existentes o de nueva creación:
| PAÍS | NOTAS |
|---|---|
| Angola | 11-2021 |
| Alemania | 1-2021 IDT Biologika |
| Argelia | 9-2021 Saidal Group |
| Armenia | 4-2021 Negociaciones producción interna 19-9-2021 Inicio producción Sputnik Light en Liqvor Pharmaceuticals |
| Austria | 2-2021 |
| Baréin | 3-6-2021 nueva planta producción |
| China | 29-3-2021 Contrato producción interna Shenzhen Yuanxing Gene-tech 1-4-2021 Contrato producción interna TopRidge Pharma 19-4-2021 Contrato producción interna Hualan Biological Engineering |
| Ecuador | 8-2021 acuerdo producción 12-2021 nuevas negociaciones |
| Egipto | 4-2021 Minapharm y su subsidiario alemán ProBioGen |
| España | 3-2021 Zendal |
| Francia | 11-2020 |
| Hungría | finales 2022 |
| Italia | 6-2021 acuerdos producción 8-3-2021 Lote de prueba en Adienne Pharma |
| Indonesia | 7-2021 |
| Líbano | 6-2021 Arwan Pharmaceutical Industries 6-2021 y 10-2022 posibles acuerdos producción |
| México | Laboratorios de Biológicos y Reactivos de México Birmex 5-7-2021 lote de prueba 11-2021 producción comercial esperada (4-4,5 millones al mes) 3-2022 no hay producción activa |
| Perú | 2023 nueva planta producción 31-8-2021 acuerdos producción |
| Turquía | 4-2021 Viscoran Ilaç y CinnaGen Pharmaceuticals |
En agosto de 2020, según las autoridades rusas, había al menos 20 países que querían obtener la vacuna. El RDIF anunció planes para vender 100 millones de dosis a la India, 35 millones a Uzbekistán y 32 millones a México, así como 25 millones a Nepal y Egipto cada uno. En diciembre de 2020, el RDIF, había recibido pedidos de más de 1200 millones de dosis. Más de 50 países habían solicitado dosis y los suministros para el mercado mundial eran producidos por socios en India, Brasil, República Popular China, Corea del Sur y otros países. En la Unión Europea, RDIF firmó acuerdos de producción con compañías de Italia, Alemania, España y Francia, que estaban sujetos a la aprobación de las agencias europeas. A finales de marzo de 2021, RDIF declaró que se habían fabricado 33 millones de dosis en Rusia, de las cuales se había exportado menos del 5 %. El fondo ruso que supervisa la distribución de la vacuna firmó en marzo de 2021 un acuerdo con la compañía farmacéutica Adienne para la producción en Italia. Si se llegara a un acuerdo sería la primera asociación de este tipo dentro de la UE. La Sputnik V fabricada en Rusia se dirigía a mercados de exportación, debido a la aceptación relativamente baja y al escepticismo generalizado de la vacuna entre los rusos. El 10 de marzo de 2021 el grupo biofarmacéutico español Zendal, declaró su interés en producir la vacuna Sputnik V. Zendal no confirmó o negó las conversaciones y dijo que las propuestas eran confidenciales. El Ministerio de Salud de España dijo no tener conocimiento de ningún contrato para fabricar Sputnik V, después de que el fondo soberano RDIF dijera que había llegado a acuerdos en España, Italia, Francia y Alemania. El Ministerio de Industria francés tampoco confirmó que alguna empresa en Francia hubiese firmado un contrato de este tipo. En enero de 2021 el desarrollador de Sputnik V estuvo en negociaciones con la compañía alemana IDT Biologika para acordar una posible producción de la vacuna. A finales de enero, Angela Merkel, se comunicó con el presidente ruso para ofrecer la ayuda de su gobierno para obtener la aprobación por parte de la Unión Europea y el deseo de cooperar en la producción.
A finales de enero de 2022, según la Global Commission for Post-Pandemic Policy, la producción total de vacunas Sputnik V fue de 275 millones de dosis. De ellas 266,4 millones corresponden a las producidas en Rusia y 8,5 millones de dosis más en Kazajistán. Fue la séptima vacuna mundial en número de dosis producidas mostrando grandes diferencias con las 6 primeras con 2647, 2563, 2466, 2274, 752 y 321,6 millones de dosis, respectivamente. Según el Centro de Epidemiología y Microbiología Gamaleya de Moscú, en enero de 2022 se habían distribuido a nivel mundial más de 400 millones de vacunas Sputnik V.
Durante la campaña de vacunación en Argentina, y también en otros países, hubo desabastecimiento del segundo componente de la vacuna. La carencia tenía como origen aspectos técnicos de la producción ya que el segundo componente de la vacuna Sputnik V es más costoso de producir, ralentizando las dosis producidas. Este segundo componente está basado en el vector adenoviral humano (Ad5), del cual habían llegado hasta el 30 de marzo de 2021 a Argentina poco más de 1 millón de dosis, y hasta el 26 mayo solo 80 000 dosis más. Del total de 8 115 745 dosis de Sputnik V que se recibieron hasta mayo de 2021 con el vector Ad26, sólo 1 140 160 correspondían al componente 2. El laboratorio Richmond explicó que era debido al bajo rendimiento productivo del cultivo celular de la segunda dosis. Su rendimiento es significativamente inferior al del primer componente, más o menos de un 25 %, por lo que hubo más oferta del componente 1. En enero de 2023, Sputnik V fue incluida por la revista científica Nature en la lista de las vacunas más administradas para combatir el COVID-19 a escala mundial. Son solo ocho vacunas las que constituyen la casi totalidad de las 16 000 millones de dosis producidas, ocupando Sputnik V el octavo lugar.
(Véase también: Autorización por otros reguladores y aceptación de Sputnik V en el mundo)
Impacto económico y logística
El precio estimado en el 2020 para cada país, estuvo determinado por factores como los costos de producción y la logística. En muchos países, como Rusia, los gastos de vacunación están cubiertos por los programas nacionales del seguro de salud. Se pretendía que el costo fuese competitivo, ya que no se buscaba un gran beneficio de la vacuna por lo que no excedería de 10 USD por dosis, lo que la hacía mucho más asequible en comparación con las vacunas de otros fabricantes. En la UE se prohibió expresamente que el precio de las vacunas se hiciera público. A pesar de esto, en diciembre de 2020, en Bélgica apareció por error en las redes sociales una lista de las vacunas negociadas. En esta se mostraba que todas las vacunas de fabricación occidental tenían un costo de entre 1,78 € hasta 14,7 € por dosis. Eslovaquia llegó a publicar su contrato con la vacuna, pudiéndose conocer el precio para Eslovaquia y Hungría que fue de 9,90 € por dosis. También se supo del precio negociado en otros países como en Angola, en abril de 2021 que negoció la compra a 18,5 USD la dosis. En Egipto el costo fue de unos 13 USD en febrero de 2021. Emiratos Árabes Unidos hizo una oferta a Ghana de Sputnik V a un costo de 19 USD por dosis en junio de 2021. En marzo de 2021 Rusia ofreció a Pakistán la vacuna a 26-28 USD por las dos dosis, pero finalmente las vacunas se comercializaron de forma privada y se les permitió el precio de 80 USD.
La vacuna del Centro Gamaleya requiere 2 dosis, en las que se usan vectores diferentes en los que se inserta un gen que codifica la proteína S de las espículas del virus SARS-CoV-2. En la primera dosis se usa el adenovirus tipo 26 (Ad26) como vector; en la segunda dosis, que se aplica al cabo de 21 días, se usa el adenovirus tipo 5 (Ad5), para potenciar la respuesta. La primera, que contiene el componente 1, en el formato de vial de 3 mL tiene tapón azul y cápsula metálica. El segundo vial contiene el componente 2, también de 3 mL, y el tapón de su frasco es rojo. Deben inyectarse necesariamente en esa secuencia. Estas vacunas multidosis especifican que son válidas para aplicar 5 dosis. Una nueva presentación de la vacuna se compone de una caja individual con 5 ampollas monodosis. La caja presenta una franja de color azul que indica que se trata del componente 1 y con color rojo para el componente 2. Las ampollas usan el mismo código de color en el texto impreso en ellas. Es necesario identificar en otros posibles colores distintos en las tapas, el Componente 1 o 2 (KOMNOHEHT I - KOMNOHEHT II) según la inscripción presente en el cuerpo del frasco o ampolla.
La logística para la distribución de las vacunas Sputnik V hace más exigente el cumplimiento de las condiciones de la cadena de frío, ya que tienen que mantenerse en todo momento a 18 °C bajo cero para su conservación. Se trasladan en camiones y aviones refrigerados y en destino se almacenan en cámaras frigoríficas. Cada caja conservadora lleva un dispositivo Datalogger o registrador de datos para certificar que durante todo el proceso hayan estado refrigeradas adecuadamente. En el caso de que algún lote de vacunas no se haya mantenido a la temperatura necesaria, se la mantiene refrigerada hasta que se determinen las medidas que se tomaran con ese lote.
En noviembre de 2020 comenzó la producción de la vacuna Sputnik V en forma liofilizada. Esta versión en polvo de la vacuna permite su almacenamiento a temperaturas entre 2 y 8 °C sobre cero. Hasta ahora se podía suministrar en la forma líquida que se debía conservar a -18 °C hasta 6 meses. El fabricante garantizó la estabilidad de la vacuna a la temperatura de entre 2 y 8 °C sobre cero mediante el formato liofilizado. La forma liofilizada está enfocada a una mayor facilidad logística en zonas remotas o países con recursos limitados. La creación de esta forma es más lenta y costosa y posteriormente es necesario diluirla antes de su inoculación. Es denominada como Gam-COVID-Vac-Lyo y fue desarrollada especialmente para el suministro de vacunas en zonas de difícil alcance en la Federación Rusa. El Ministerio de Salud de Argentina actualizó el 3 de febrero de 2021 el Manual del vacunador por notificación del Ministerio de Salud de la Federación Rusa, con relación al procedimiento de uso de Sputnik V después de la descongelación de la vacuna. El formato líquido requiere de una temperatura de congelación de -18 °C o menor para todas las etapas de almacenamiento y transporte hasta el momento de su uso. Se recomienda que una vez descongelada la vacuna, las cinco dosis que contiene el vial sean administradas en un plazo máximo de dos horas después de la descongelación. Anteriormente se recomendaba un tiempo máximo de 30 minutos.
La fecha de caducidad de la vacuna Sputnik V fue ampliada en agosto de 2022 por el Ministerio de Sanidad ruso de seis meses a un año dependiendo de los distintos fabricantes. Se examinó la vacuna durante todo el período hasta la nueva fecha de vencimiento, viendo que el nivel de calidad se mantenía. Los cambios fueron prescritos en las instrucciones para la vacuna indicando que la vida útil más corta indicada en envases previos a la decisión de renovar la caducidad, no es señal de que el medicamento esté vencido. Dados los cortos plazos para el desarrollo de vacunas para el COVID-19, esta práctica también se ha utilizado en la Unión Europea y Estados Unidos con agencias reguladoras estrictas.
Distribución, vacunación y percepción pública
Autorización de uso de emergencia por la OMS y la EMA
Evaluación para el uso de emergencia por la OMS
La Organización Mundial de la Salud (OMS), para evaluar vacunas que están todavía sin autorizar, utiliza un procedimiento de inclusión en la lista de uso en emergencias (EUL). Durante las emergencias de salud pública evalúa los datos de calidad, seguridad y eficacia, para decidir si pueden utilizarse fuera de los ensayos clínicos. El 20 de agosto de 2020, poco después de la aprobación de la vacuna Sputnik en Rusia, la oficina de la OMS en Europa inició conversaciones con Rusia para tratar de obtener más información sobre la vacuna. Se discutieron los diversos pasos e información que serían necesarios para que la OMS realizara sus evaluaciones. El director regional para Europa en la OMS, Hans Kluge, dijo el 21 de septiembre de 2020 que la OMS apreciaba enormemente los esfuerzos que había realizado la Federación rusa para desarrollar una vacuna segura y eficaz contra el COVID-19.
En enero de 2021, la vacuna Sputnik V se enfrentó a una oleada de críticas de los medios occidentales, que insistían en que la vacuna necesitaba más ensayos para ser considerada segura. La OMS denunciaba la desigualdad en la distribución de las vacunas, pero autorizó el uso de solamente una vacuna contra el COVID-19. El secretario general de la ONU, Antonio Guterres, el 2 de febrero de 2021 expresó su deseo de que la Organización Mundial de la Salud aprobara lo antes posible la Sputnik V porque podría jugar un papel muy importante en la lucha contra el coronavirus. El 9 de febrero de 2021 La OMS confíaba en que la vacuna Sputnik V, una vez autorizada para su uso de emergencia, se pondría a disposición de la iniciativa COVAX. El lunes 8 de febrero, la OMS empezó una ronda de consultas sobre Sputnik V. El 27 de abril de 2021, la Organización Mundial de la Salud aún estaba en discusiones sobre la vacuna Sputnik V y no había fijado una fecha para evaluar la toma de datos clínicos. Estaban a la espera y no tenían programada una reunión de revisión. En mayo de 2021 UNICEF se convirtió en la primera agencia de la ONU en solicitar 220 millones de dosis de Sputnik V, aun sin estar autorizada para uso de emergencia por la OMS. El 2 de junio de 2021 el máximo funcionario de la OMS en Europa dijo que la salud estaba más allá de la política y era optimista sobre la autorización de emergencia de la vacuna Sputnik V. Lamentó que esa postura no fuera compartida por todos reconociendo que en la mayoría de los países la pandemia se politizó muy rápidamente. En ese momento los inspectores estaban en Rusia visitando los diferentes sitios de producción. Cuando concluyera la misión de los especialistas de la OMS, se darían una serie de recomendaciones que el fabricante debería cumplir para aumentar las posibilidades de que se aprobase la vacuna. El 4 de junio de 2021, Kirill Dmítriev, director del Fondo Ruso de Inversión Directa (RDIF) esperaba que la OMS aprobase Sputnik V en dos meses. El 23 de junio de 2021 la OMS encontró infracciones de producción en un fabricante de la vacuna Sputnik V. Tenían preocupación por la posible contaminación cruzada y por controles de esterilización insuficientes durante una inspección en una fábrica involucrada en la fabricación. En un informe provisional la organización describió seis infracciones en una planta de Pharmstandard ubicada en Ufá (Rusia), uno de los cuatro sitios que visitó el equipo de inspección de la OMS. También destacaron posibles problemas con los sistemas utilizados para rastrear e identificar lotes de vacunas individuales y preocupaciones por actividades de control de calidad. La empresa Pharmstandard - UfaVITA respondió aclarando y publicando detalladamente las cuestiones que se referían solo a cuatro aspectos. La OMS no tenía objeciones sobre la seguridad y eficacia de la vacuna producida y terminada, ya que Sputnik V se sometía a un estricto control de producción del Centro Gamaleya y el regulador de salud ruso (Roszdravnadzor). En realidad la inspección de la OMS no identificó ningún problema crítico con la producción real de la vacuna, la calidad, los estudios clínicos, los posibles efectos secundarios, ni con el control de calidad. En cambio, la atención de los inspectores de la OMS se centró en cuatro cuestiones técnicas, la mayoría relacionadas con una de las líneas de llenado, que posteriormente se abordaron en su totalidad.
Aunque en junio de 2021, la Organización Mundial de la Salud solo había autorizado el uso de emergencia de seis vacunas contra la COVID-19, entre las que no está la Sputnik V, asumía que cada gobierno y autoridad regulatoria podían aprobar el uso en un país de una vacuna, aunque no se hubiese incluido en la lista de la OMS para uso de emergencia. El 2 de julio de 2021 Sputnik continuaba en proceso de evaluación. Según la OMS los avances realizados son: reuniones de presentación previa, expediente aceptado, presentación continua de datos de fabricación y controles de productos químicos (CMC) y de clínica y se han requerido datos adicionales. La fecha de la inspección sería fijada una vez que todos los datos estuviesen presentados y hubiese seguimiento de las inspecciones. El 6 de julio de 2021 se publica en Nature que las preocupaciones sobre el seguimiento de los efectos secundarios podrían ser la razón por la cual la OMS y la EMA aún no habían emitido una autorización de uso de emergencia. La OMS solicitó más datos al Centro Gamaleya y las inspecciones de las instalaciones de ensayos y fabricación de Rusia estaban en curso. Se habían inspeccionado nueve lugares, encontrando la OMS preocupaciones sobre uno de ellos. El Fondo Ruso de Inversión Directa (RDIF) anunció el 13 de julio de 2021, que esperaba que la Organización Mundial de la Salud aprobase la vacuna en septiembre u octubre de 2021. En enero de 2022 el Ministerio de Salud de Argentina, por petición de la Organización Mundial de la Salud, aportó datos de estudios sobre la efectividad de la vacuna Sputnik V, para facilitar su aprobación por parte del organismo. La ministra argentina, Carla Vizzotti, pidió a la OMS la aprobación de uso de emergencia de la vacuna. Había más de 19 millones de argentinos vacunados con Sputnik V y la falta de validación por parte de la OMS era un problema para aquellos que necesitaban viajar al exterior. Además la falta de la autorización de emergencia generaba dudas sobre la vacuna entre la población.
En marzo de 2022 la Organización Mundial de la Salud estaba en el tramo final del proceso para aprobar la vacuna. Tenía previsto realizar inspecciones en territorio ruso el 7 de marzo y también en la planta de producción Richmond en Argentina. Estas fueron postergadas por los problemas logísticos que se presentaron a raíz del enfrentamiento bélico entre Rusia y Ucrania, lo que dificultaba reservar vuelos a Rusia y utilizar tarjetas de crédito. El 18 de enero del 2022, un mes antes de que se desplegara el conflicto, la OMS había dicho que Rusia ya había presentado la mayoría de los datos solicitados para avanzar con la aprobación de emergencia. Se esperaba que eso sucedería durante el primer trimestre del año 2022. Aun así, según el subdirector del Centro Gamaleya, Denis Logunov, las consultas con la OMS seguían en curso, y se planeaba una nueva fecha para la llegada de la inspección de la organización a Rusia. El 26 de mayo de 2022 la OMS en su relación de vacunas en proceso de evaluación, incluía la vacuna Sputnik V y aclaraba que el proceso se había reiniciado, esperando la finalización de la presentación continua y acciones correctivas y preventivas para la última inspección.
En noviembre de 2022 Sputnik figuraba en la relación de vacunas en proceso de evaluación aún en proceso. En mayo de 2022 las vacunas autorizadas para uso de emergencia por la OMS eran 11. La vacuna Sputnik V no había sido registrada como vacuna autorizada por la OMS contra el COVID-19, en enero de 2023.
Evaluación para el uso de emergencia por la EMA
El 22 de octubre de 2020, el Fondo Ruso de Inversión Directa (RDIF) solicitó a la Agencia Europea de Medicamentos (EMA) asesoramiento científico para gestionar la autorización de la vacuna Sputnik V. El asesoramiento, que fue realizado el 19 de enero de 2021, contó con la participación de representantes del RDIF y de la EMA, así como desarrolladores de la vacuna Sputnik V. El registro de la vacuna en la Unión Europea fue solicitado el 29 de enero de 2021 e inició el proceso de presentación de la información a la EMA a través del procedimiento de revisión continua". El RDIF estaba completamente abierto a proporcionar toda la información necesaria y afirmó que la Unión Europea podría otorgar su aprobación a la vacuna Sputnik V a principios de marzo de 2021.
La EMA estaba en contacto con el fabricante de la vacuna, pero la UE no tenía intención de comprarla de forma centralizada para los Estados miembros. La Agencia Europea del Medicamento aunque estaba examinando los datos, aún no tenía formal de autorización. La compañía no tenía en ese momento capacidad de producción en Europa y por tanto no cumplía uno de los criterios más importantes de selección para Europa. Según la EMA el 10 de febrero de 2021 no había recibido una solicitud para revisión continua o autorización de comercialización para la Sputnik V, a pesar de informes que indicaban lo contrario. Los desarrolladores si habían recibido asesoramiento científico de la EMA que les proporcionaba la última orientación normativa y científica para el desarrollo de la vacuna. El Comité de Medicamentos Humanos y el Grupo de Trabajo sobre la pandemia de la EMA deberían primero dar su conformidad, antes de que los desarrolladores pudieran enviar su solicitud para el inicio del proceso de revisión continua. El 19 de febrero de 2021 se informó que la confusión sobre la oferta de aprobación de la vacuna podría ser el resultado de una solicitud mal dirigida. La presentación de la vacuna para la aprobación del regulador fue enviada a la agencia equivocada, según un documento ruso y una aclaración del proceso de solicitud por parte del regulador. El fondo soberano RDIF que es responsable de comercializar la vacuna, estuvo en disputa con la EMA sobre si se había enviado o no para su aprobación. Se publicó una confirmación de la presentación en el 'Twitter' de Sputnik V, que mostraba que se había enviado a los Directores de Agencias de Medicamentos (HMA). La EMA dijo que la HMA no formaba parte del proceso de solicitud de la aprobación. En enero, la UE negó haber recibido una presentación para la vacuna, pero que se estaba intercambiando asesoramiento científico. En respuesta, RDIF compartió la captura de pantalla que mostraba la documentación enviada el 29 de enero a un portal del sitio web administrado por la HMA y marcado como recibido. La EMA no podía encontrar la documentación enviada para su revisión. RDIF esperaba que la EMA comenzara la revisión continua y lo anunciara oficialmente en su sitio web.
El 15 de febrero de 2021 la EMA envió carta al RDIF con el asunto: 'Nombramiento de relatores del CHMP para Gam-COVID-Vac', informando que el Comité de Medicamentos Humanos (CHMP) había nombrado los revisores para la evaluación inicial de las autorizaciones de comercialización en toda la UE. Según las normas, solo después de recibir la aprobación de los 'relatores' y del Grupo de trabajo contra la pandemia, las autoridades rusas técnicamente podrían registrar la solicitud de revisión continua.
El 4 de marzo de 2021, el Comité de Medicamentos Humanos (CHMP) tomó la decisión de iniciar la revisión continua de Sputnik V, siendo este un paso necesario para el proceso de autorización. El solicitante ruso de este medicamento en la UE fue R-Pharm Germany. El organismo inició su revisión continua dados los resultados de laboratorio y los estudios clínicos en adultos efectuados hasta ahora. La evaluación se llevaba a cabo a través del CHMP. Si el Comité emitiese una opinión positiva, se enviaría a la Comisión Europea para que se transformara en una autorización de comercialización válida para toda la UE. El 8 de marzo de 2021 los desarrolladores de Sputnik V exigieron disculpas al jefe de la Agencia Europea de Medicamentos después de llamar a la aprobación de la vacuna 'ruleta rusa'. El 15 de marzo de 2021 la Agencia Europea del Medicamento comunicó que verían si en las próximas semanas podrían aprobar la vacuna, pero que hasta finales de abril no estaban preparados para aprobarla y que más bien sería en mayo de 2021. Simultáneamente algunos gobiernos de la UE estaban considerando iniciar conversaciones con los desarrolladores de Sputnik V. Estos valoraron las solicitudes de cuatro estados de la UE para iniciar el proceso de asegurar suministros debido a la ralentización del proceso por la estrategia de adquisiciones centralizadas de Europa. El mismo día la Unión Europea desestimó públicamente la campaña de Rusia para el suministro de vacunas contra el coronavirus como 'un truco de propaganda de un régimen indeseable'. El 17 de marzo de 2021 el portavoz de la Comisión Europea, Stefan De Keersmaecker, dijo que no mantenía negociaciones con los representantes de Sputnik V sobre la posible compra de la vacuna. También en marzo de 2021 el comisionado francés del Mercado Interno de la Unión Europea, Thierry Breton, afirmó que el bloque europeo no tenía 'absolutamente ninguna necesidad' de Sputnik V, diciendo que tenían claramente la capacidad de administrar de 300 a 350 millones de dosis y para julio tendrían la posibilidad de alcanzar la inmunidad en todo el continente.
El 4 de abril de 2021 el ministro de Sanidad ruso, Mijaíl Murashko, anunció la llegada de una delegación de la Agencia Europea del Medicamento a Moscú el 10 de abril para revisar los ensayos clínicos de la Sputnik V. La EMA no comunicó oficialmente esta misión. Este viaje podría suponer la fase final para que el regulador europeo incluyese la vacuna entre las autorizadas. El 7 de abril de 2021 la EMA planeaba iniciar una investigación para establecer si los ensayos clínicos de Sputnik V cumplieron con los niveles científicos y éticos adecuados. Estaban preocupados de que pudieran no haberse cumplido los estándares éticos. No se describieron esas preocupaciones en detalle aunque hubo denuncias de que algunos participantes en los ensayos de la vacuna pudieron haber sido obligados a participar. Los productores de la vacuna, a través del 'Twitter' de Sputnik V, calificó el informe como falso e incorrecto. El 13 de abril de 2021 la EMA aseguró que aún no había recibido una solicitud del desarrollador ruso de Sputnik V para estudiar una posible licencia para su uso en la Unión Europea, y advirtió de que solo la respaldaría cuando se demostrase que sus beneficios generales superan sus riesgos. Según la EMA, la vacuna se encontraba bajo revisión continua, lo que suponía un análisis en tiempo real de los datos compartidos por el desarrollador. Este proceso destinado a acelerar en el futuro el estudio de una posible licencia de uso condicional, no reduce los requisitos para la aprobación de la vacuna. El 29 de abril de 2021 los reguladores de la UE completaron la investigación especial ética en los ensayos clínicos de la vacuna Sputnik V. Los resultados de la investigación de la EMA solo se publicarían una vez que se hubiesen completado todas las etapas. Un equipo de inspección de la EMA en Moscú realizó una inspección de 'Buenas Prácticas Clínicas' para verificar el estándar internacional de calidad ética y científica para diseñar, registrar e informar de ensayos. El director ejecutivo de la EMA, Emer Cooke, dijo que esa inspección era una parte adicional del procedimiento de solicitud, pero que seguía siendo parte del proceso normal del regulador. Las inspecciones pueden ser provocadas por problemas que surjan durante la evaluación del expediente o por otra información de inspecciones previas. En mayo de 2021 la EMA inspeccionó las fábricas de Sputnik V en Rusia para corroborar que se cumplían los estándares europeos. Cuando se completasen las revisiones, los resultados se agregarían al proceso de evaluación. Se trataba de asegurar que se habían cumplido los estándares éticos en los ensayos clínicos y en los controles de manufacturación.
El proceso de revisión de la vacuna Sputnik V por la OMS y la Agencia Europea de Medicamentos seguía su curso el 4 de junio de 2021. El 16 de junio de 2021 la Unión Europea informó que la aprobación de la vacuna Sputnik V se retrasaría porque no se enviaron los datos dentro de la fecha límite del 10 de junio. El gobierno alemán, dijo que el hecho de no proporcionar los datos de ensayos clínicos al organismo de control de medicamentos de la UE pospondría cualquier aprobación en el bloque. La aprobación de Sputnik V se retrasaría probablemente hasta septiembre o tal vez hasta fin de año. La EMA dio al desarrollador de la vacuna otra semana para presentar los datos requeridos. El Fondo Ruso de Inversión Directa dijo que se había proporcionado toda la información sobre los ensayos clínicos de la vacuna Sputnik V y que se completó la revisión de la GCP (Práctica clínica general) con comentarios positivos de la Agencia Europea de Medicamentos. El equipo esperaba la aprobación de la vacuna en los próximos dos meses. El 15 de julio de 2021 se publicó que los esfuerzos europeos para evaluar la vacuna Sputnik V se ven obstaculizados por la repetida falta de datos. Las vulneraciones no eran críticas, se asociaban a la falta de experiencia de los desarrolladores de la vacuna con el trabajo de los funcionarios europeos. El RDIF calificó los informes sobre la falta de información como completamente incorrectos.
El 12 de julio de 2021 había cuatro vacunas en revisión continua por la EMA, entre ellas la Sputnik V y además había otras cuatro ya autorizadas. La EMA no podía proporcionar plazos exactos, ya que dependían del aporte de los datos necesarios para la revisión del CHMP. Según el regulador europeo, Rusia no había proporcionado datos clínicos sobre los efectos adversos de Sputnik V ni sobre el banco de células maestras y de su núcleo biológico, lo que era importante para su aprobación. A mediados de julio de 2021, a pesar de la falta de la aprobación de la OMS y la EMA, Sputnik V se había autorizado en 71 países de todo el mundo. Dos países de la UE: Hungría y Eslovaquia y Serbia, candidato a la UE, aprobaron la vacuna a través de sus propios organismos reguladores, sin la autorización de la EMA. En agosto de 2021 el RDIF aclaró que el proceso de aprobación por la Agencia Europea de Medicamentos avanzaba de manera positiva y profesional, aunque lamentaba las declaraciones politizadas de la Comisión Europea acerca de falta de información sobre la vacuna y de cuestiones relacionadas con su seguridad. Afirmaron que todos los datos sobre los ensayos clínicos de Sputnik V fueron proporcionados en el marco de los controles de buenas prácticas clínicas rusas y que se recibió un informe positivo de la EMA. Sin embargo, la presidenta de la Comisión Europea, Ursula von der Leyen, insistió en que la EMA no tenía datos válidos suficientes para demostrar la seguridad de la vacuna Sputnik V y aprobar su uso. Por su parte, el ministro de exteriores ruso aseguró que los especialistas de la Agencia Europea de Medicamentos no habían expresado previamente quejas sobre Sputnik V y su efectividad. Al mismo tiempo, calificó de infundados los ataques de Occidente contra las vacunas rusas y el aumento del grado de retórica agresiva.
Autorización por otros reguladores y aceptación de Sputnik V en el mundo
| 74 países, entre ellos: |
● Países que no la han utilizado (o no hay datos de su uso) hasta la fecha:
|
● Países que la han rechazado totalmente posteriormente a su autorización :
|
● Países con autorización parcial:
|
| ◎Vacuna autorizada o aprobada |
| ■Vacuna no autorizada o aprobada |
| ◀Vacuna rechazada después autorización |
| ▶Vacuna autorización limitada |