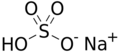Bisulfato de sodio para niños
Datos para niños
Bisulfato de sodio |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Hidrogenosulfato de sodio | ||
| General | ||
| Otros nombres | Bisulfato sódico | |
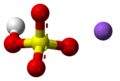
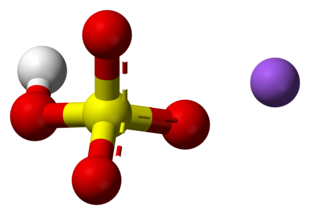
| Fórmula semidesarrollada | Na+ (S(OH)O3)- | |
| Fórmula estructural | 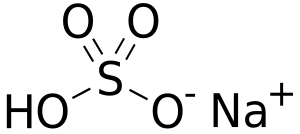 |
|
| Fórmula molecular | NaHSO4 | |
| Identificadores | ||
| Número CAS | 7681-38-1 (anhidro) | |
| Número RTECS | VZ1860000 | |
| ChEMBL | CHEMBL1200488 | |
| ChemSpider | 56397 | |
| PubChem | 516919 | |
| UNII | BU8V88OWIQ | |
|
[Na+].[O-]S(=O)(=O)O
|
||
|
InChI
InChI=1S/Na.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+1;/p-1
Key: WBHQBSYUUJJSRZ-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Apariencia | sólido blanco | |
| Densidad | 2742 kg/m³; 2,742 g/cm³ | |
| Masa molar | 120,06 g/mol | |
| Punto de fusión | 331,6 K (58 °C) | |
| Punto de descomposición | 588 K (315 °C) | |
| Estructura cristalina | triclínico (anhidro) monoclínico (monohidratado) |
|
| Propiedades químicas | ||
| Acidez | 1,99 pKa | |
| Solubilidad en agua |
28,5 g/100 mL (25 °C) |
|
| Solubilidad | Insoluble en amoníaco | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
|
|
| Frases R | R34 R37 R41 | |
| Frases S | S26 S36 S37 S39 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El bisulfato de sodio es un compuesto químico. Es un tipo de sal que se forma cuando el ácido sulfúrico se mezcla con una sustancia de sodio, como el hidróxido de sodio o el cloruro de sodio. Su fórmula química es NaHSO4.
Este compuesto se presenta como un polvo o gránulos de color blanco. Cuando no tiene agua (se le llama "anhidro"), puede absorber la humedad del aire. Las soluciones de bisulfato de sodio son muy ácidas, similares al jugo de limón.
Contenido
¿Cómo se produce el bisulfato de sodio?
Existen varias formas de fabricar bisulfato de sodio.
Producción con hidróxido de sodio
Una manera de obtener bisulfato de sodio es mezclando hidróxido de sodio con ácido sulfúrico en cantidades exactas. Esta reacción produce bisulfato de sodio sin agua y también agua.
- NaOH + H2SO4 → NaHSO4 + H2O
Producción con cloruro de sodio
Otro método consiste en hacer reaccionar cloruro de sodio (la sal de mesa común) con ácido sulfúrico a altas temperaturas. De esta reacción se obtiene bisulfato de sodio líquido y un gas llamado cloruro de hidrógeno.
- NaCl + H2SO4 → NaHSO4 + HCl
El bisulfato de sodio que se forma, que contiene una molécula de agua (monohidratado), se enfría rápidamente para que se convierta en pequeñas gotas sólidas. El gas cloruro de hidrógeno se disuelve en agua para crear ácido clorhídrico, que es otro producto útil de este proceso.
Producción con otras sustancias
El bisulfato de sodio también se puede obtener al fabricar otros ácidos importantes. Esto ocurre cuando las sales de sodio de esos ácidos reaccionan con un exceso de ácido sulfúrico. Por ejemplo:
En muchos de estos casos, los ácidos que se producen tienen un punto de ebullición más bajo que los materiales iniciales. Esto permite separarlos de la mezcla mediante un proceso llamado destilación, que usa el calor para separar líquidos.
¿Para qué se usa el bisulfato de sodio?
El uso principal del bisulfato de sodio es hacer que las soluciones sean más ácidas.
Usos en la industria y el hogar
- Se utiliza para purificar metales.
- Es un ingrediente en muchos productos de limpieza.
- Ayuda a reducir el pH del agua en piscinas y bañeras, lo que hace que el cloro funcione mejor para mantener el agua limpia.
- Está aprobado para usarse como aditivo en alimentos, incluyendo la comida para mascotas, para hacerlos más ácidos.
Usos especiales
- Es muy dañino para algunos equinodermos (animales marinos como las estrellas de mar). Por eso, se usa para controlar ciertas plagas de estrellas de mar, como la Acanthaster planci.
- En la fabricación de joyas, el bisulfato de sodio es el ingrediente principal en las soluciones que se usan para limpiar los metales. Estas soluciones ayudan a quitar la capa de óxido que se forma cuando el metal se calienta.
- Antiguamente, el bisulfato de sodio sin agua era el componente principal de algunos limpiadores de inodoros. Esto se debía a que, al mezclarse con agua, se volvía corrosivo y ayudaba a limpiar.
Galería de imágenes
Véase también
 En inglés: Sodium bisulfate Facts for Kids
En inglés: Sodium bisulfate Facts for Kids