Autoinmunidad para niños
Datos para niños Autoinmunidad |
||
|---|---|---|
 |
||
| Especialidad | Inmunología | |
La autoinmunidad ocurre cuando el sistema de defensa de nuestro cuerpo, que normalmente nos protege de gérmenes y enfermedades, se confunde. En lugar de atacar solo a los invasores dañinos, empieza a atacar por error a nuestras propias células y tejidos sanos.
Cualquier enfermedad que surge de esta confusión del sistema inmune se llama "enfermedad autoinmune". Algunos ejemplos conocidos son la celiaquía, la diabetes mellitus tipo 1, el lupus eritematoso sistémico (LES) y la artritis reumatoide (AR). Estas enfermedades a menudo se tratan con medicamentos que ayudan a controlar la inflamación.
Contenido
- ¿Cómo se descubrió la autoinmunidad?
- Autoinmunidad de bajo nivel: ¿Puede ser útil?
- Tolerancia inmunológica: ¿Cómo se evita el ataque?
- Inmunodeficiencia y autoinmunidad: ¿Hay una conexión?
- Factores genéticos: ¿La herencia influye?
- Sexo: ¿Hay diferencias entre hombres y mujeres?
- Factores ambientales: ¿Qué más influye?
- ¿Cómo se desarrollan las enfermedades autoinmunes?
- Clasificación de las enfermedades autoinmunes
- Diagnóstico de la autoinmunidad
- Tratamientos para la autoinmunidad
- Véase también
- Enlaces externos
¿Cómo se descubrió la autoinmunidad?
A finales del siglo XIX, los científicos pensaban que el sistema inmune nunca atacaría los propios tejidos del cuerpo. Paul Ehrlich, a principios del siglo XX, propuso la idea de "horror autotoxicus", que significaba que el cuerpo tenía mecanismos para evitar atacarse a sí mismo.
Más tarde, Ehrlich cambió su teoría. Reconoció que era posible que el sistema inmune atacara los tejidos propios. Sin embargo, creía que el cuerpo tenía protecciones naturales para evitar que esto causara enfermedades graves.
En 1904, esta idea fue desafiada. Se descubrió una sustancia en la sangre de pacientes con una enfermedad rara que reaccionaba con sus propios glóbulos rojos. En las décadas siguientes, se encontraron más enfermedades relacionadas con respuestas autoinmunes.
A pesar de esto, la teoría de Ehrlich era muy influyente. Esto hizo difícil entender estos nuevos hallazgos. En la década de 1950, la comprensión moderna de las enfermedades autoinmunes comenzó a crecer. Hoy en día, se acepta que las respuestas autoinmunes de bajo nivel son una parte normal del sistema inmune de los animales con columna vertebral.
Autoinmunidad de bajo nivel: ¿Puede ser útil?
Aunque un nivel alto de autoinmunidad es perjudicial, un nivel bajo puede ser beneficioso. Algunos científicos creen que la autoinmunidad es un mecanismo de defensa. Podría ayudar al cuerpo a mantenerse equilibrado.
También se piensa que la autoinmunidad puede ayudar a una respuesta inmune rápida al inicio de una infección. Esto ocurre cuando hay pocos gérmenes presentes. En estos casos, el reconocimiento de las propias células por parte del sistema inmune ayuda a mantener las células de defensa listas para actuar.
Tolerancia inmunológica: ¿Cómo se evita el ataque?
Científicos como Noel Rose, Ernst Witebsky, Ivan Roitt y Deborah Doniach demostraron que enfermedades como la artritis reumatoide están relacionadas con la pérdida de la tolerancia inmunológica. La tolerancia inmunológica es la capacidad del cuerpo para ignorar sus propias células y reaccionar solo a lo que es extraño.
Cuando esta tolerancia se rompe, el sistema inmune ataca sus propias partes. La forma exacta en que se desarrolla la tolerancia inmunológica aún se investiga. Sin embargo, se han propuesto varias teorías:
- Teoría de la deleción clonal: Propuesta por Frank Macfarlane Burnet. Sugiere que las células de defensa que podrían atacarse a sí mismas son destruidas durante el desarrollo del sistema inmune. Por este trabajo, Burnet y Peter B. Medawar ganaron el Premio Nobel en 1960.
- Teoría de la anergia clonal: Propuesta por Gustav Nossal. Dice que las células de defensa que podrían atacarse a sí mismas se inactivan en una persona sana. Así, no pueden aumentar la respuesta inmune.
- Teoría de la red de idiotipos: Propuesta por Jerne. Explica que existe una red de anticuerpos en el cuerpo que pueden neutralizar los anticuerpos que se atacan a sí mismos.
Además, hay otras teorías bajo investigación:
- Teoría de la ignorancia clonal: Sugiere que algunas células de defensa autorreactivas maduran y viajan por el cuerpo. Sin embargo, no encuentran el "antígeno" (la señal) adecuado para activarse, porque están en tejidos a los que no pueden acceder.
- Teoría de las células T reguladoras: Propone que un tipo especial de células de defensa, llamadas linfocitos T reguladores, evitan o limitan las respuestas inmunes que se atacan a sí mismas.
Estas teorías no se excluyen mutuamente. Es probable que varios de estos mecanismos trabajen juntos para mantener la tolerancia inmunológica en nuestro cuerpo.
Inmunodeficiencia y autoinmunidad: ¿Hay una conexión?
Existen muchas condiciones en las que el sistema inmune no funciona correctamente (inmunodeficiencia) y que también presentan características de autoinmunidad. Cuando el sistema inmune tiene dificultades para eliminar infecciones, esto puede causar autoinmunidad. Esto ocurre porque el sistema inmune se mantiene activado constantemente.
Un ejemplo es la Inmunodeficiencia común variable (IDCV). En esta condición, se observan varias enfermedades autoinmunes, como problemas intestinales o de tiroides.
Otro ejemplo es la linfohistiocitosis hemofagocítica familiar. Aquí, las personas a menudo tienen problemas con las células sanguíneas, erupciones en la piel e inflamación de órganos. Se cree que esto se debe a infecciones virales que el cuerpo no puede eliminar.
Factores genéticos: ¿La herencia influye?
Algunas personas tienen una mayor probabilidad genética de desarrollar enfermedades autoinmunes. Esta probabilidad está ligada a varios genes y otros factores. Sin embargo, tener una predisposición genética no significa que la persona siempre desarrollará una enfermedad autoinmune.
Se sospecha que tres grupos principales de genes están involucrados en muchas enfermedades autoinmunes:
- Genes relacionados con las inmunoglobulinas (anticuerpos).
- Genes relacionados con los receptores de células T.
- Los principales complejos de histocompatibilidad (MHC).
Los dos primeros grupos de genes son muy variables. Esto permite que el sistema inmune responda a muchos tipos de invasores. Pero estas variaciones también pueden llevar a que algunas células de defensa reaccionen contra el propio cuerpo.
Por ejemplo:
- El gen HLA DR2 se relaciona con el lupus eritematoso sistémico y la esclerosis múltiple.
- El HLA DR3 se relaciona con el síndrome de Sjögren y la diabetes mellitus tipo 1.
- El HLA DR4 se relaciona con la artritis reumatoide y la diabetes mellitus tipo 1.
También hay correlaciones con otros genes, como el HLA B27, que se asocia con enfermedades como la espondilitis anquilosante.
Sexo: ¿Hay diferencias entre hombres y mujeres?
| Relación de incidencia mujer/hombre
de enfermedades autoinmunes |
|
|---|---|
| Tiroiditis de Hashimoto | 10:1 |
| Enfermedad de Graves-Basedow | 7:1 |
| Esclerosis múltiple (EM) | 2:1 |
| Miastenia gravis | 2:1 |
| Lupus eritematoso sistémico (LES) | 9:1 |
| Artritis reumatoide | 5:2 |
| Colangitis esclerosante primaria | 1:2 |
Hay evidencia de que el sexo de una persona puede influir en el desarrollo de la autoinmunidad. La mayoría de las enfermedades autoinmunes son más comunes en mujeres.
Las mujeres suelen tener respuestas inflamatorias más fuertes que los hombres. Esto podría aumentar su riesgo de autoinmunidad. Los cambios hormonales también parecen influir, ya que muchas enfermedades autoinmunes varían con el ciclo menstrual o durante el embarazo.
Una teoría sugiere que el intercambio de células entre madres e hijos durante el embarazo podría inducir autoinmunidad en la madre. Otra teoría apunta a una inactivación desequilibrada del cromosoma X en mujeres.
Factores ambientales: ¿Qué más influye?
Enfermedades infecciosas y parásitos
Existe una relación interesante entre las enfermedades infecciosas y las autoinmunes. En lugares donde las enfermedades infecciosas son muy comunes, las enfermedades autoinmunes son raras. Y viceversa.
La "hipótesis de la higiene" sugiere que esto se debe a cómo los gérmenes manipulan nuestro sistema inmune. Algunos estudios indican que las infecciones por parásitos pueden reducir la actividad de las enfermedades autoinmunes. Se cree que el parásito "calma" la respuesta inmune del huésped para protegerse a sí mismo. Esto podría beneficiar a una persona con una enfermedad autoinmune.
Sin embargo, algunos microbios están fuertemente asociados con enfermedades autoinmunes. Por ejemplo, ciertas bacterias y virus se han relacionado con la espondilitis anquilosante y la diabetes mellitus tipo 1. Esto podría deberse a que estos microbios producen sustancias que activan de forma excesiva las células de defensa, lo que lleva a la producción de anticuerpos que atacan el propio cuerpo.
Agentes químicos y medicamentos
Ciertos productos químicos y medicamentos también pueden estar relacionados con el desarrollo de condiciones autoinmunes. Un ejemplo es el lupus eritematoso inducido por fármacos. Generalmente, al dejar de tomar el medicamento, los síntomas desaparecen.
Fumar es un factor de riesgo importante para la artritis reumatoide. Esto podría estar relacionado con cambios en las proteínas del cuerpo.
¿Cómo se desarrollan las enfermedades autoinmunes?
Se cree que varios mecanismos contribuyen al desarrollo de las enfermedades autoinmunes. Esto ocurre en personas con una predisposición genética y bajo la influencia de factores ambientales. Aquí te explicamos algunos de los mecanismos importantes:
- Activación de células de defensa por error: Normalmente, las células B (que producen anticuerpos) necesitan la ayuda de las células T para activarse. Pero a veces, ciertos gérmenes pueden activar las células B directamente, haciendo que produzcan muchos anticuerpos, algunos de los cuales pueden atacar el propio cuerpo.
- Confusión en el reconocimiento de antígenos: Las células B y T reconocen diferentes partes de un invasor. En la autoinmunidad, una célula B puede reconocer una parte de una proteína del cuerpo y, al mismo tiempo, recibir ayuda de una célula T que reconoce una parte de un germen. Esto puede llevar a que la célula B ataque el propio cuerpo.
- Señales erróneas en las células B: En las enfermedades autoinmunes, la unión de anticuerpos a ciertas partes de las células puede enviar señales equivocadas a las células B. Esto hace que las células B autorreactivas (las que atacan el propio cuerpo) sobrevivan y sigan atacando, superando los mecanismos que normalmente las detendrían.
- Mimetismo molecular: Un germen puede tener una estructura muy parecida a una parte de nuestro cuerpo. Así, los anticuerpos que se producen para atacar al germen también pueden, por error, unirse a nuestras propias células y causar una respuesta inmune. Un ejemplo es la fiebre reumática, que ocurre después de una infección por estreptococos.
- Desregulación de citocinas: Las citocinas son proteínas que regulan la respuesta inmune. Un desequilibrio en estas citocinas puede llevar a una inflamación excesiva y a respuestas autoinmunes.
- Problemas en las células dendríticas: Las células dendríticas son importantes para presentar "señales" a las células de defensa. Si estas células dendríticas tienen defectos, pueden activar las células de defensa de forma inadecuada, lo que lleva a la autoinmunidad.
- Cambio en el objetivo del ataque (difusión de epítopos): La respuesta inmune puede empezar atacando una parte específica y luego extenderse a otras partes, incluso si no son estructuralmente similares.
- Exposición de partes ocultas (modificación del epítopo): A veces, ciertas partes de las proteínas de nuestras células, que normalmente están ocultas, se exponen debido a daños o inflamación. Esto puede activar el sistema inmune, que las reconoce como extrañas y las ataca.
Los científicos también están investigando el papel de células inmunes especiales, como las células T reguladoras, en el desarrollo de estas enfermedades.
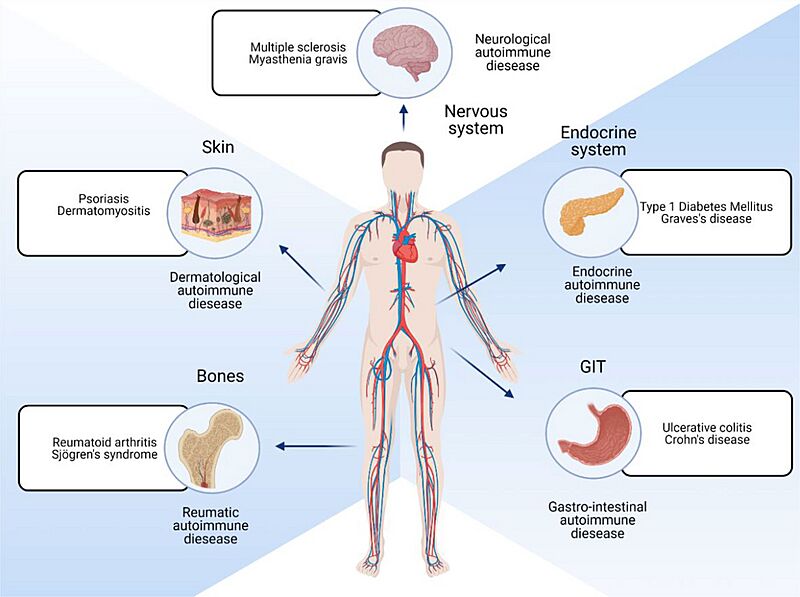
Clasificación de las enfermedades autoinmunes
Las enfermedades autoinmunes se pueden clasificar en dos grandes grupos:
- Enfermedades autoinmunes sistémicas: Afectan a muchos órganos y tejidos del cuerpo. Ejemplos incluyen la celiaquía, el lupus eritematoso y la artritis reumatoide. En estas enfermedades, los anticuerpos atacan partes que no son específicas de un solo tejido.
- Síndromes locales (o específicos de órgano): Afectan principalmente a un órgano o tejido en particular.
- Endocrinológicos: Como la diabetes mellitus tipo 1 (afecta el páncreas) o la tiroiditis de Hashimoto (afecta la tiroides).
- Gastrointestinales: Como la enfermedad de Crohn (afecta el intestino).
- Dermatológicos: Como el pénfigo vulgar (afecta la piel).
- Hematológicos: Como la anemia hemolítica autoinmune (afecta los glóbulos rojos).
- Neurológicos: Como la esclerosis múltiple (afecta el cerebro y la médula espinal) o la miastenia gravis (afecta los músculos).
Es importante saber que no toda la inflamación crónica en el cuerpo se debe a un ataque de las células B y T. Por eso, algunos expertos proponen ver la autoinmunidad como un "continuo de enfermedades inmunológicas". Esto incluye tanto las enfermedades autoinmunes clásicas como otras enfermedades impulsadas por el sistema inmune innato (la primera línea de defensa del cuerpo).
Diagnóstico de la autoinmunidad
Para diagnosticar un trastorno autoinmune, los médicos se basan en la historia clínica del paciente, un examen físico cuidadoso y la sospecha. También se realizan pruebas de laboratorio, como la medición de la proteína C reactiva (que indica inflamación).
En muchos trastornos, se pueden usar pruebas de sangre para detectar autoanticuerpos específicos. Para los trastornos que afectan un órgano específico, a menudo se toma una pequeña muestra de tejido (biopsia) y se examina.
Los autoanticuerpos son muy útiles para diagnosticar y seguir el progreso de muchas enfermedades autoinmunes.
Tratamientos para la autoinmunidad
Los tratamientos para las enfermedades autoinmunes suelen buscar reducir la actividad del sistema inmune (inmunosupresores), disminuir la inflamación (antiinflamatorios) o aliviar los síntomas (cuidados paliativos). Controlar la inflamación es clave.
Algunas terapias no inmunológicas, como el reemplazo hormonal en la tiroiditis de Hashimoto o la diabetes tipo 1, tratan los efectos de la enfermedad. En la celiaquía, una dieta especial ayuda a controlar los síntomas. Medicamentos como los esteroides o los AINE (antiinflamatorios no esteroideos) reducen la inflamación.
También existen terapias más específicas que modulan el sistema inmune. Por ejemplo, algunos medicamentos bloquean ciertas proteínas o células de defensa. Aunque estas terapias pueden ser muy útiles, a veces aumentan el riesgo de infecciones.
Se están investigando nuevas terapias, como la "terapia con helmintos" (que usa ciertos parásitos intestinales) y la "vacunación con células T", como posibles tratamientos futuros.
Nutrición y autoinmunidad
Vitamina D y luz solar
La vitamina D es importante para el sistema inmune. Muchas células del cuerpo tienen receptores para la vitamina D. Se ha encontrado una relación entre niveles bajos de vitamina D y enfermedades autoinmunes como la esclerosis múltiple, la diabetes mellitus tipo 1 y el lupus eritematoso sistémico. Sin embargo, en el lupus, se aconseja evitar el sol, lo que puede contribuir a la deficiencia de vitamina D.
Ácidos grasos omega-3
El consumo adecuado de ácidos grasos omega-3 puede ayudar a contrarrestar la inflamación en las enfermedades autoinmunes. Estudios en humanos y animales sugieren que el omega-3 es útil para la artritis reumatoide, la enfermedad inflamatoria intestinal y la psoriasis.
Probióticos y microflora
Algunos tipos de bacterias beneficiosas, como las presentes en productos lácteos fermentados (por ejemplo, Lactobacillus casei), pueden estimular la respuesta inmune y regular su función. Esto podría ayudar a retrasar o prevenir la aparición de enfermedades como la diabetes.
Antioxidantes
Se ha pensado que los antioxidantes podrían reducir el riesgo de diabetes tipo 1 en bebés. Sin embargo, un estudio no encontró una relación significativa entre la ingesta de antioxidantes y el riesgo de diabetes.
Véase también
 En inglés: Autoimmune disease Facts for Kids
En inglés: Autoimmune disease Facts for Kids
- Enfermedad autoinmune
- Autoinmunidad protectora
- Psiconeuroinmunología
Enlaces externos

