Ventaja heterocigótica para niños
Una ventaja heterocigótica ocurre cuando un organismo que tiene dos versiones diferentes de un gen (una de cada padre, llamado heterocigoto) es más fuerte o tiene más posibilidades de sobrevivir y reproducirse que los organismos que tienen dos copias iguales de ese gen (llamados homocigotos).
Cuando esta ventaja se debe a un solo gen, se le llama sobredominancia. Esto significa que las características visibles (fenotipo) del heterocigoto son mejores que las de cualquiera de los dos tipos de homocigotos.
Este fenómeno ayuda a mantener la variedad genética en una población, ya que la selección natural favorece a los individuos heterocigotos. Un ejemplo conocido es el de la anemia de células falciformes, donde ser heterocigoto para el gen de esta enfermedad ofrece una ventaja.
A veces, un solo gen puede influir en varias características de un organismo, algunas beneficiosas y otras no. El entorno del organismo juega un papel importante en determinar si ese gen será favorecido o no, hasta que se alcance un equilibrio.
La ventaja heterocigótica es una de las razones detrás de la heterosis, también conocida como "vigor híbrido". Esto se refiere a la mejora en las características biológicas de la descendencia que resulta de la mezcla de genes de padres diferentes. Investigaciones han mostrado que esta ventaja puede deberse a que los genes "buenos" de un padre ocultan los genes "malos" del otro, o a que los genes trabajan juntos de una manera especial. También se ha descubierto que hay una contribución epigenética, que son cambios en cómo se expresan los genes sin alterar el código genético en sí.
Contenido
¿Cómo funciona la ventaja heterocigótica?
Cuando dos grupos de organismos de la misma especie se separan y viven aislados por mucho tiempo, las mutaciones (cambios en los genes) que son perjudiciales pueden aparecer de forma diferente en cada grupo. Es poco probable que las mismas mutaciones dañinas sean comunes en ambos grupos después de mucho tiempo.
Como las mutaciones que causan problemas suelen ser recesivas (es decir, solo se manifiestan si se tienen dos copias del gen mutado), si se cruzan individuos de los dos grupos, la descendencia será más fuerte. Esto se debe a que es probable que hereden una copia "buena" del gen de un padre y una copia "mala" del otro, lo que los convierte en heterocigotos y les da una ventaja.
Este concepto se enfoca en la sobredominancia, donde la ventaja de la descendencia se debe a ser heterocigoto en un solo gen específico.
Ejemplos de ventaja heterocigótica
Se ha demostrado la ventaja heterocigótica en varios organismos, incluyendo a los humanos. La primera vez que se confirmó experimentalmente fue con la mosca de la fruta Drosophila melanogaster. Un estudio clásico con la mutación "ébano" mostró cómo la variedad genética puede mantenerse en una población gracias a esta ventaja.
Si la mutación "ébano" solo causara desventajas, la selección natural la eliminaría de la población. Sin embargo, esta mutación también ofrecía ventajas, mejorando la capacidad de supervivencia de las moscas heterocigotas. Estas moscas no mostraban las desventajas de las homocigotas, pero sí tenían una mayor capacidad de supervivencia. Las moscas "normales" (homocigotas de tipo salvaje) eran sanas, pero no tenían esa ventaja de supervivencia y, por lo tanto, estaban en desventaja frente a las heterocigotas en términos de supervivencia y reproducción.
Esta mutación, que al principio parecía dañina, resultó ser beneficiosa para los heterocigotos, lo que permitió que se mantuviera en la población. El estudio mostró que el gen "ébano" persistió a través de muchas generaciones de moscas. Su presencia era más común y ventajosa en ambientes fríos y secos, pero menos en ambientes cálidos y húmedos.
En humanos
Anemia falciforme
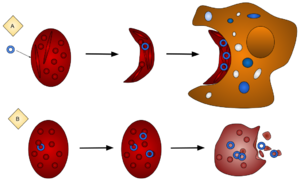
La anemia falciforme (SCA) es una enfermedad genética causada por tener dos copias de un gen defectuoso. Cuando los glóbulos rojos de una persona con SCA se exponen a poco oxígeno, pierden su forma redonda y se vuelven como una hoz. Estas células en forma de hoz pueden bloquear los vasos sanguíneos pequeños, impidiendo que otras partes del cuerpo reciban suficiente oxígeno. Sin tratamiento, la SCA puede causar dolor, daño a los órganos internos, accidentes cerebrovasculares y anemia, y a menudo lleva a una vida más corta.
Sin embargo, si una persona tiene solo una copia del gen de la SCA y una copia normal, tendrá lo que se llama "rasgo de células falciformes". Esto significa que no sufrirá los efectos graves de la enfermedad, pero algunos de sus glóbulos rojos pueden deformarse ligeramente sin causar daño. Estas personas son "portadoras". Si dos portadores tienen un hijo, hay un 25% de probabilidad de que el hijo tenga SCA, un 50% de probabilidad de que sea portador, y un 25% de probabilidad de que no tenga la enfermedad ni sea portador. Si el gen de la SCA solo causara problemas, su frecuencia disminuiría hasta desaparecer.
Pero hay una ventaja clara para los heterocigotos en áreas donde la malaria es común. Las personas con el rasgo de células falciformes son resistentes a la infección por malaria. El parásito de la malaria vive parte de su vida en los glóbulos rojos y causa una caída en los niveles de oxígeno. En los portadores, esta caída es suficiente para que las células infectadas se deformen y sean eliminadas rápidamente del cuerpo, lo que limita la infección. Estas personas tienen una gran resistencia a la malaria y más posibilidades de sobrevivir a los brotes.
Las personas con dos copias del gen de la SCA pueden sobrevivir a la malaria, pero suelen morir por su enfermedad genética si no reciben atención médica avanzada. Las personas con dos copias del gen normal (homocigotas "normales") tienen más posibilidades de transmitir sus genes, pero son más vulnerables a morir por malaria antes de poder tener hijos.
Esta resistencia a la malaria es la razón principal por la que el gen de la SCA y la enfermedad aún existen. Se encuentra más a menudo en poblaciones donde la malaria ha sido un problema grave. Por ejemplo, aproximadamente uno de cada diez afroamericanos es portador, debido a que sus antepasados provienen de regiones afectadas por la malaria. Otras poblaciones en África, India, el Mediterráneo y el Medio Oriente también tienen una alta frecuencia de este gen.
Fibrosis quística
La fibrosis quística (FQ) es una enfermedad hereditaria que afecta los pulmones, las glándulas sudoríparas y el sistema digestivo. Es causada por un problema en una proteína que controla el movimiento de iones de cloruro, lo cual es vital para el equilibrio del agua en el cuerpo. Esta proteína defectuosa hace que se forme una mucosidad espesa en los pulmones y el intestino. Antes de la medicina moderna, los niños con FQ vivían solo unos pocos años, pero ahora pueden llegar a la edad adulta, aunque a menudo tienen problemas de fertilidad. Es la enfermedad genética más común entre las personas de origen europeo.
Tener una sola mutación de FQ puede ayudar a las personas a sobrevivir a enfermedades que causan pérdida de líquidos corporales, como la diarrea. Una de estas enfermedades es el cólera, que comenzó a afectar a los europeos mucho después de que la mutación de la FQ ya estuviera presente en la población. Otra enfermedad contra la que la FQ podría proteger es la fiebre tifoidea. Las personas con cólera a menudo mueren por deshidratación. Un estudio con ratones en 1994 sugirió que los ratones heterocigotos (portadores) tenían menos diarrea que los ratones normales, lo que llevó a pensar que la resistencia al cólera explicaba la alta frecuencia del gen de la FQ.
Sin embargo, estudios más recientes en humanos han puesto en duda esta teoría.
Otra idea es que la mutación de la FQ proporciona resistencia a la tuberculosis. La tuberculosis causó muchas muertes en Europa entre 1600 y 1900, por lo que incluso una protección parcial podría explicar la frecuencia actual del gen.
Una hipótesis más reciente sugiere que una sola mutación de la FQ dio una ventaja respiratoria a los primeros europeos que se movieron hacia el norte, a las tierras polvorientas que quedaron después de la última Edad de Hielo.
Hasta 2016, la razón exacta de la alta frecuencia del gen de la FQ sigue siendo incierta. Aproximadamente una de cada 25 personas de origen europeo es portadora de la enfermedad, y uno de cada 2500 a 3000 niños nacidos la padece.
Isomerasa de triosafosfato
La triosafosfato isomerasa (TPI) es una enzima importante en la glucólisis, el proceso principal por el cual las células obtienen energía de los azúcares. En humanos, algunas mutaciones en esta enzima causan una enfermedad rara llamada deficiencia de triosafosfato isomerasa. Otras mutaciones que inactivan la enzima son mortales si se heredan dos copias defectuosas del gen TPI (homocigotas), pero no tienen un efecto claro en los heterocigotos (una copia defectuosa y una normal). Sin embargo, la frecuencia de los genes defectuosos en heterocigotos es mucho mayor de lo esperado, lo que sugiere una ventaja heterocigótica. La razón no se conoce con certeza, pero nuevos estudios sugieren que las células con menos actividad de TPI son más resistentes al estrés oxidativo.
Resistencia a la infección por el virus de la hepatitis C
Hay pruebas de que ser genéticamente heterocigoto en humanos ofrece una mayor resistencia a ciertas infecciones virales. Se ha observado que hay menos heterocigosidad en un gen llamado HLA-DRB1 entre las personas infectadas con el virus de la hepatitis C (VHC) que entre las no infectadas. Esto sugiere que tener diferentes versiones de este gen (ser heterocigoto) proporciona una ventaja contra el avance de la infección por VHC a una enfermedad hepática grave.
Heterocigosidad MHC y preferencias de olor humano
Varios estudios han demostrado que las mujeres prefieren el olor de los hombres que son heterocigotos en tres genes específicos del MHC. Las razones de esto son especulativas, pero se cree que tener más variedad en estos genes del MHC permite al cuerpo luchar contra una mayor variedad de enfermedades, lo que podría aumentar las posibilidades de supervivencia. Un experimento con ratones ha demostrado que los ratones heterocigotos para el MHC tenían mejor salud y supervivencia frente a múltiples infecciones.
BAFF y enfermedades autoinmunes
El factor de activación de células B (BAFF) es una proteína que ayuda a regular la respuesta inmune. Una variación en el gen que produce BAFF hace que se genere más de esta proteína. Esta variación está relacionada con enfermedades como el lupus eritematoso sistémico y la esclerosis múltiple, pero los portadores heterocigóticos de esta variación tienen menos posibilidades de contraer malaria.
Véase también
 En inglés: Heterozygote advantage Facts for Kids
En inglés: Heterozygote advantage Facts for Kids