Epigenética para niños
La epigenética es el estudio de cómo los genes se activan o desactivan sin que cambie la secuencia de ADN que los forma. Imagina que tus genes son como un libro de instrucciones. La epigenética no cambia las palabras de ese libro, sino que decide qué páginas se leen y cuáles no, o con qué frecuencia se leen.
Estos cambios en la actividad de los genes pueden ser causados por cosas como la edad o el ambiente que te rodea, incluyendo lo que comes, si haces ejercicio o incluso algunos medicamentos. Lo más interesante es que estas "marcas" epigenéticas pueden durar mucho tiempo y, a veces, incluso pasar de padres a hijos.
El término "epigenética" fue creado por C.H. Waddington en 1942. Él lo usó para hablar de cómo los genes y el ambiente interactúan para que un organismo se desarrolle. Es como si la epigenética fuera el puente entre la información genética que heredas y cómo esa información se manifiesta en tu cuerpo, influenciada por tu vida.
Las "marcas epigenéticas" no son genes, pero son muy importantes. Así como el genoma es el conjunto completo de todos tus genes, el epigenoma es el conjunto completo de todas estas marcas epigenéticas que regulan cómo se usan tus genes.
Después de que se completó el Proyecto Genoma Humano en 2003, los científicos se dieron cuenta de que hay mucho más en cómo funcionan nuestras células, cómo nos desarrollamos, envejecemos y por qué aparecen algunas enfermedades. La idea de que somos solo lo que está escrito en nuestros genes desde que nacemos está cambiando. Ahora sabemos que nuestras experiencias pueden dejar "marcas" en nuestro material genético, y estas marcas pueden ser transmitidas a futuras generaciones.
La epigenética nos ayuda a entender cómo la información del ADN se traduce y se usa en el cuerpo. Se ha visto que los mecanismos epigenéticos están relacionados con muchos procesos del cuerpo, incluyendo el desarrollo de algunas enfermedades.
Contenido
¿Para qué sirve la epigenética?
La epigenética se estudia en diferentes áreas de la biología:
En el desarrollo de los seres vivos
En esta área, la epigenética se refiere a cómo se regulan los genes sin cambiar el ADN. También estudia cómo el desarrollo de un embrión depende de su entorno, tanto interno (como los materiales de la madre) como externo (como la temperatura o la luz).
En la evolución
Aquí, la "herencia epigenética" se refiere a cómo algunas características se pueden heredar sin que haya cambios en los genes mismos.
En las poblaciones
Se usa el término "variación epigenética" para describir cómo diferentes condiciones ambientales pueden hacer que organismos con los mismos genes se vean o se comporten de manera distinta. Por ejemplo, algunos cambios epigenéticos son reversibles y hacen que los genes se activen o desactiven según el ambiente.
En la salud
La epigenética es muy importante en la prevención y el estudio de algunas enfermedades. Se han desarrollado tecnologías para predecir cómo se comportarán los genes. La industria farmacéutica está muy interesada en crear medicamentos que puedan controlar estos cambios epigenéticos, especialmente en el estudio de algunas enfermedades, ya que los factores epigenéticos juegan un papel clave en su desarrollo.
La epigenética nos muestra cómo el cuerpo se adapta al ambiente. Estas modificaciones son muy estables y pueden pasar de una célula a otra por muchas generaciones. Esto es importante porque si hay errores en estas modificaciones, pueden aparecer enfermedades que se mantengan en una familia por mucho tiempo.
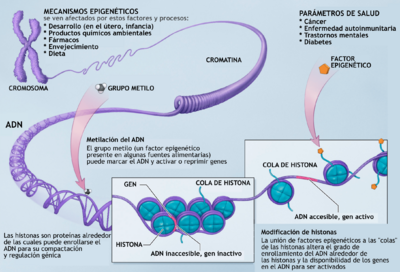
La regulación epigenética puede ocurrir por cambios en la forma de la cromatina, que es como el ADN se empaqueta dentro de la célula. Si la cromatina está muy apretada, los genes no se pueden leer. Si está más abierta, los genes sí se pueden leer. Esta es una forma en que se controla la actividad de los genes.
Hay tres procesos epigenéticos principales:
- La metilación del ADN.
- La modificación de las histonas.
- El efecto de los ARN pequeños no codificantes.
Estructura de los cromosomas
La parte interna de los cromosomas tiene tres capas:
- Genes que producen proteínas: Son los que conocemos como los principales portadores de la herencia.
- Genes que no producen proteínas: Son muy importantes porque, junto con las histonas, forman la cromatina. Producen ARN que puede cambiar el comportamiento de los genes que sí producen proteínas.
- Capa epigenética de la información: Es fundamental para el desarrollo, el crecimiento, el envejecimiento y algunas enfermedades. No cambia la secuencia del ADN, pero sí influye en cómo se expresan los genes. Los mecanismos epigenéticos pueden combinar señales genéticas y ambientales para controlar cómo se desarrolla un organismo.
Las "epimutaciones" son cambios epigenéticos que, según algunas teorías, podrían estar relacionadas con algunas enfermedades. Las variaciones epigenéticas también pueden explicar por qué los gemelos idénticos, que tienen el mismo ADN, pueden mostrar algunas diferencias.
Mecanismos epigenéticos de regulación de genes
Los principales mecanismos epigenéticos a nivel molecular son la metilación del ADN y la modificación de las histonas.
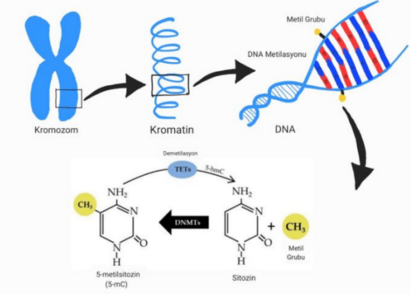
Metilación del ADN
La metilación del ADN es un proceso en el que se añade una pequeña molécula (un grupo metilo) a una parte del ADN llamada citosina. Cuando hay mucha metilación, la cromatina se cierra y los genes se "apagan". La dieta puede influir en esto, ya que algunas sustancias de los alimentos (como la metionina o el ácido fólico) ayudan a añadir estos grupos metilo.
La metilación es importante para procesos normales del cuerpo, como la inactivación de uno de los cromosomas X en las mujeres o la "impronta" de genes, donde solo una copia de un gen (la del padre o la de la madre) se activa. Si hay problemas en este proceso, pueden aparecer algunas enfermedades. Por ejemplo, si un gen que debería estar "apagado" se activa, puede llevar a problemas de crecimiento.
Se ha visto que la metilación también es una forma de defensa contra virus y otros organismos que podrían dañar el ADN.
Metilación del ADN y la salud
La metilación del ADN es clave para que los genes se activen o desactiven correctamente. Se ha demostrado que cambios en la metilación del ADN están relacionados con la activación o desactivación de genes de forma no esperada. Esto se ha observado en el desarrollo de algunas enfermedades.
Modificación de histonas
Las histonas son proteínas alrededor de las cuales se enrolla el ADN para formar la cromatina. Las histonas pueden ser modificadas de varias maneras (como la acetilación o la metilación). Estas modificaciones actúan como un "código" que le dice al gen si debe activarse o silenciarse.
Acetilación de histonas
La acetilación es una de las modificaciones más comunes. Cuando las histonas están acetiladas, la cromatina se abre y los genes pueden leerse. Si las histonas no están acetiladas, la cromatina se cierra y los genes se "apagan". Un equilibrio adecuado de acetilación es fundamental para la regulación de los genes en las células. Alteraciones en este equilibrio pueden afectar la expresión de los genes.
Metilación de histonas
Las histonas también pueden ser metiladas. A diferencia de la acetilación, el efecto de la metilación puede variar: a veces activa un gen y otras veces lo silencia, dependiendo de dónde ocurra la metilación. La metilación de histonas puede cambiar la estructura de la cromatina, lo que también afecta la actividad de los genes.
ARN no codificante
Existen pequeños ARN que no producen proteínas, pero que pueden regular la actividad de los genes. Por ejemplo, los micro ARN pueden unirse a otros ARN y evitar que se conviertan en proteínas, "apagando" así el gen. Estos ARN son importantes en muchos procesos, como el desarrollo, el envejecimiento y la respuesta al estrés.
Todos estos mecanismos epigenéticos son esenciales para el correcto desarrollo y funcionamiento de un organismo. Si se descontrolan, pueden llevar a problemas. La epigenética asegura que la cromatina esté bien organizada en el núcleo de la célula, regulando la expresión de los genes en el momento y lugar adecuados.
Técnicas para estudiar la metilación del ADN
RIMS-seq2
RIMS-seq2 es una técnica moderna y avanzada que permite estudiar el ADN y, al mismo tiempo, obtener información sobre la metilación. Es muy útil para entender cómo la información genética y epigenética trabajan juntas. Se usa en campos como la biología del desarrollo y la investigación de algunas enfermedades.
Esta técnica funciona modificando ligeramente el ADN para identificar dónde están los grupos metilo. Así, los científicos pueden ver cómo la metilación afecta la actividad de los genes.
Herencia epigenética
Impronta genómica
La impronta genómica es un proceso donde la metilación juega un papel importante. En mamíferos, algunos genes se activan o desactivan dependiendo de si vienen del padre o de la madre. Esto afecta el crecimiento antes del nacimiento y se ha relacionado con algunas enfermedades. Este proceso se "reprograma" en cada nueva generación. Entenderlo mejor puede ayudar a comprender algunos problemas de desarrollo.
Herencia epigenética
La herencia epigenética es la transmisión de información que no está en la secuencia del ADN, pero que modula la expresión de los genes. Los patrones de metilación del ADN son los más estudiados en este tipo de herencia.
Los tres tipos principales de información epigenética heredable son:
- Metilación del ADN: Un cambio en el ADN donde se añade un grupo metilo a la citosina, lo que influye en la expresión de los genes.
- Impronta genética: Los genes pueden cambiar su funcionamiento sin alterar su secuencia de ADN, dependiendo de si provienen del padre o de la madre.
- Modificación de histonas: Incluye procesos como la acetilación, metilación y fosforilación de las histonas.
Es importante recordar que, aunque la epigenética no cambia la secuencia del ADN, los genes que controlan estos procesos epigenéticos (como los que producen las enzimas que añaden los grupos metilo) siguen siendo fundamentales.
Programación temprana y la salud
Un ejemplo famoso de cómo el ambiente puede afectar la epigenética es el de los niños nacidos durante una época de escasez de alimentos en Holanda en 1944-1945. Las madres embarazadas no comían lo suficiente, y sus bebés nacieron con bajo peso. Aunque después de la guerra tuvieron comida normal, sus cuerpos no se recuperaron del todo. De adultos, fueron más propensos a problemas de salud como la obesidad y la presión alta.
Se cree que la falta de alimento en el útero hizo que el cuerpo del bebé se "programara" para un ambiente con poca comida, volviéndose muy eficiente en almacenar energía. Esto es un ejemplo de cómo las condiciones tempranas de vida pueden dejar una "marca epigenética" que afecta la salud a largo plazo, incluso en las siguientes generaciones.
Epigenética en el desarrollo y la adaptación
Efectos de la temperatura
La temperatura puede afectar cómo se pliegan las proteínas y, por lo tanto, cómo funcionan las enzimas. Esto puede llevar a cambios en cómo se ve o se comporta un organismo.
Mariposas: cambios de color según la estación
Algunas mariposas cambian el color de sus alas según la estación. En verano, sus alas son más claras, y en invierno, más oscuras. Los colores oscuros ayudan a absorber más calor del sol en invierno, lo que es una ventaja. Estos cambios están controlados por señales del ambiente que afectan las hormonas, y estas hormonas, a su vez, regulan la actividad de los genes.
Reptiles y peces: cómo se define el sexo
En muchas tortugas, cocodrilos y algunos peces, el sexo del embrión depende de la temperatura a la que se desarrolla el huevo. Por ejemplo, en cocodrilos, temperaturas altas pueden producir más hembras. Esto ayuda a que la población tenga más hembras, lo cual es bueno para la especie.
Efectos de la nutrición
Lo que un organismo come puede enviar señales químicas que causan cambios en su desarrollo.
Abejas: la jalea real y la abeja reina
En las abejas, si una larva come jalea real durante todo su desarrollo, se convierte en una abeja reina. Si come jalea real solo por poco tiempo, se convierte en una obrera. La jalea real causa cambios en las hormonas de la larva, lo que afecta la actividad de sus genes y determina si será reina o una obrera.
Escarabajos: el tamaño de los cuernos
En algunas especies de escarabajos, la cantidad y calidad de alimento que reciben los machos durante su desarrollo determina el tamaño de sus cuernos. Más alimento significa cuernos más largos. Los machos con cuernos cortos, debido a una alimentación deficiente, desarrollan comportamientos diferentes para poder reproducirse.
Humanos y el sistema de defensas
Se ha visto que la dieta de una mujer embarazada puede influir en la actividad de los genes de su bebé. Por ejemplo, en un estudio en Gambia, los bebés concebidos durante la época de lluvias tenían una actividad diferente en un gen importante para el sistema de defensas, lo que sugiere una influencia de la dieta materna.
Efectos de la presencia de otros organismos
Algunos organismos pueden detectar la presencia de sus depredadores y desarrollar estructuras para protegerse. Por ejemplo:
- Un pequeño crustáceo llamado Daphnia puede desarrollar una cabeza con forma de casco puntiagudo.
- Un caracol puede producir una concha más gruesa.
- Los renacuajos de una especie de rana pueden salir de sus huevos antes de tiempo si sienten las vibraciones de las serpientes.
Las señales de otros miembros de la misma especie también pueden cambiar el desarrollo. Por ejemplo, las langostas pueden cambiar su color y comportamiento si hay muchas juntas y los recursos son escasos, volviéndose más agresivas y con alas más largas para migrar. Algunos peces pueden cambiar de sexo dependiendo de la interacción con otros peces de su especie.
Biomarcadores epigenéticos
Un biomarcador es cualquier cambio en el material genético que se puede detectar en un organismo. Los biomarcadores epigenéticos detectan moléculas que indican si un gen está activo o inactivo. Por ejemplo, una alta cantidad de moléculas de metilo puede indicar que un gen está "apagado".
Estos marcadores son útiles para identificar diferencias entre un estado normal y un estado donde hay cambios epigenéticos que podrían llevar a una enfermedad. Se están usando para detectar algunas enfermedades de forma temprana, tomando muestras de fluidos corporales como la sangre.
Generación de enfermedades
El conocimiento de la epigenética ha permitido avances en terapias. Se ha investigado cómo revertir el "silenciamiento" de genes. Por ejemplo, en ratones con un síndrome específico, se logró que recuperaran la capacidad de producir una proteína, lo que mejoró sus síntomas.
La idea de que las "marcas epigenéticas" pueden heredarse es clave para el éxito de estas terapias. Si los cambios en la cromatina pueden ser influenciados por el ambiente y ser heredables, esto es muy importante para entender cómo los organismos se adaptan.
Los cambios epigenéticos, como la adición de grupos metilo, pueden alterar el funcionamiento de las enzimas y hacer que algunas regiones del ADN sean más sensibles a cambios. Esto puede llevar a cambios en el organismo y aumentar la posibilidad de desarrollar enfermedades.
Epigenética y la salud
La epigenética está dando nuevas ideas sobre algunas enfermedades. Por ejemplo, se ha visto que las células afectadas por ciertas enfermedades tienen patrones de metilación del ADN diferentes a los de las células normales. Esto se usa hoy en día para el diagnóstico.
También se ha estudiado cómo las modificaciones en las histonas se ven afectadas en las células con problemas. La investigación en este campo sigue avanzando para entender mejor cómo se desarrollan las enfermedades y encontrar nuevas formas de combatirlas.
Posibles problemas con algunas técnicas de ayuda para la concepción
Se ha planteado la pregunta de si el tiempo que los embriones pasan en un ambiente de laboratorio durante algunas técnicas de ayuda para la concepción podría afectar los procesos epigenéticos. El desarrollo temprano del embrión es un momento crítico para muchos cambios epigenéticos. Aunque la mayoría de los niños nacidos con estas técnicas se desarrollan normalmente, se ha observado una tendencia a que nazcan con bajo peso y un ligero aumento en la aparición de algunos síndromes.
Se cree que la manipulación en varias etapas de estas técnicas, como el uso de hormonas o el cultivo de embriones en laboratorio, podría alterar la impronta genética. Aunque la mayoría de los datos provienen de estudios en animales, hay evidencia de que estas técnicas pueden estar relacionadas con alteraciones en la impronta.
Por ejemplo, se ha visto que en algunos casos de infertilidad masculina hay relación con los marcadores epigenéticos. También se han encontrado diferencias en la metilación en la placenta y en la sangre del cordón umbilical de niños concebidos con estas técnicas.
Los estudios en ratones han mostrado que el cultivo de embriones en laboratorio puede afectar la metilación. También se ha observado que los embriones obtenidos de óvulos estimulados hormonalmente presentan más alteraciones de la metilación.
Véase también
 En inglés: Epigenetics Facts for Kids
En inglés: Epigenetics Facts for Kids
- Biología del desarrollo
- Genética del desarrollo
- Metilación
- Paisaje epigenético
- Proteinoma
- Multiómica