TRePEV para niños
La Teoría de Repulsión de Pares de Electrones de Valencia (conocida como TRePEV o VSEPR) es un modelo que los químicos usan para predecir cómo se organizan los átomos en una molécula o ion poliatómico. Se basa en la idea de que los pares de electrones que están en la capa más externa de un átomo (llamada capa de valencia) se repelen entre sí. Esta repulsión hace que los electrones se coloquen de una manera específica para estar lo más lejos posible unos de otros, lo que define la forma de la molécula.
Esta teoría fue desarrollada principalmente por Ronald Gillespie y Ronald Sydney Nyholm. La idea principal es que los pares de electrones de valencia de un átomo central se empujan, buscando la posición en el espacio donde la repulsión sea mínima. El número total de pares de electrones alrededor de un átomo central (tanto los que forman enlaces como los que no) se llama número estérico.
La TRePEV es una herramienta útil para entender la geometría molecular de muchas sustancias. Aunque es un modelo sencillo, ayuda a predecir con bastante precisión las formas de las moléculas.
Contenido
Historia de la TRePEV
Orígenes de la idea
La idea de que la forma de una molécula está relacionada con el número de electrones de valencia fue propuesta por primera vez en 1940. Los científicos Nevil Sidgwick y Herbert Powell, de la Universidad de Oxford, fueron quienes presentaron este concepto inicial.
Desarrollo de la teoría
Más tarde, en 1957, Ronald Gillespie y Ronald Sydney Nyholm, de la Universidad de Londres, mejoraron esta idea. Crearon una teoría más completa que permitía elegir la forma más probable para una molécula entre varias opciones. Gracias a ellos, la TRePEV se convirtió en una herramienta más precisa para predecir las formas moleculares.
¿Cómo funciona la TRePEV?
La TRePEV se basa en un principio simple: los electrones se repelen entre sí. Imagina que tienes varios imanes con el mismo polo; intentarían alejarse lo más posible. De manera similar, los pares de electrones en la capa de valencia de un átomo central se repelen. Esta repulsión eléctrica es la que determina la geometría de la molécula o ion poliatómico.
La forma que predice la TRePEV es aquella en la que los pares de electrones están lo más separados posible, lo que significa que la molécula tiene la menor energía posible.
Tipos de pares de electrones
Los pares de electrones pueden ser de dos tipos:
- Pares de enlace: Son los electrones que se comparten entre dos átomos para formar un enlace.
- Pares no enlazantes: También llamados pares libres o solitarios. Son pares de electrones que pertenecen a un átomo pero no están formando un enlace con otro átomo.
Fuerzas de repulsión
La fuerza con la que se repelen los pares de electrones no es siempre la misma. Hay tres tipos de repulsiones, ordenadas de mayor a menor intensidad:
- Repulsión entre dos pares no enlazantes (PNE-PNE): Es la más fuerte.
- Repulsión entre un par no enlazante y un par de enlace (PNE-PE): Es intermedia.
- Repulsión entre dos pares de enlace (PE-PE): Es la más débil.
Esta diferencia en las fuerzas de repulsión es importante. Por ejemplo, si una molécula tiene pares no enlazantes, estos empujarán más fuerte a los pares de enlace, haciendo que los ángulos entre los enlaces sean más pequeños de lo esperado.
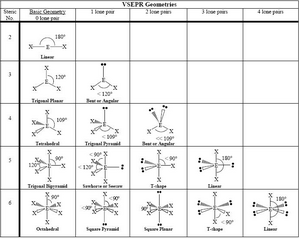
Una molécula con un átomo central se puede representar como ABnEm, donde "A" es el átomo central, "B" son los átomos que se enlazan a "A" (n es el número de enlaces), y "E" representa los pares de electrones no enlazantes (m es el número de pares no enlazantes).
Por ejemplo, si un átomo central tiene cuatro pares de electrones en su capa de valencia y todos son pares de enlace, como en el metano (CH4), los átomos se organizarán en forma de tetraedro. El ángulo entre los enlaces en un tetraedro es de 109.5 grados.
Reglas adicionales para predecir la forma molecular
Además de las repulsiones básicas, hay otras reglas que ayudan a predecir la forma de las moléculas:
- Efecto de la electronegatividad: Si los átomos que se unen al átomo central son muy electronegativos (es decir, atraen mucho los electrones), la repulsión entre los pares de enlace disminuye. Esto puede hacer que los ángulos de enlace sean un poco más pequeños. Por ejemplo, en el NH3 y el NF3, el ángulo de enlace es menor en el NF3 porque el flúor es más electronegativo que el hidrógeno.
- Enlaces múltiples: Los enlaces dobles o triples (llamados enlaces múltiples) se consideran como una sola región de electrones para la TRePEV. Esto significa que no cambian la forma general de la molécula, que está determinada principalmente por los enlaces simples y los pares de electrones libres.
- Átomos con capas incompletas: En algunos casos, si el átomo central tiene espacios vacíos para electrones, los pares de electrones libres de los átomos vecinos pueden moverse hacia esos espacios.
TRePEV comparada con otras teorías
La TRePEV es una de varias teorías que explican la forma de las moléculas. A menudo se compara con la teoría del enlace de valencia, que también describe la forma molecular, pero se enfoca en cómo los orbitales de los átomos se combinan para formar enlaces. Otra teoría es la teoría de los orbitales moleculares, que es más compleja y explica cómo los átomos y los electrones se unen para formar moléculas e iones.
Ejemplos de formas moleculares
La TRePEV es muy útil para entender la forma de moléculas comunes:
Metano (CH4)
El metano (CH4) es un ejemplo perfecto de una molécula con forma tetraédrica. El átomo de carbono central está unido a cuatro átomos de hidrógeno. Como el carbono tiene cuatro pares de electrones de enlace y ningún par no enlazante, estos cuatro pares se repelen y se colocan en los vértices de un tetraedro. El ángulo entre cada enlace carbono-hidrógeno es de 109.5 grados. Esta es una molécula del tipo AB4.
Amoníaco (NH3)
El amoníaco (NH3) tiene una forma diferente. El átomo de nitrógeno central está unido a tres átomos de hidrógeno, pero también tiene un par de electrones no enlazante. Aunque este par no forma un enlace con otro átomo, sí ocupa espacio y ejerce una fuerte repulsión. Esto significa que hay cuatro regiones de electrones alrededor del nitrógeno (tres pares de enlace y un par no enlazante).
La disposición general de estas regiones de electrones es tetraédrica, similar al metano. Sin embargo, como el par no enlazante no es "visible" como un átomo, la forma de la molécula (la disposición de los átomos) es una pirámide trigonal. Es una molécula del tipo AB3E. Debido a que el par no enlazante repele más fuertemente que los pares de enlace, los ángulos entre los enlaces nitrógeno-hidrógeno son un poco más pequeños que 109.5 grados (aproximadamente 106.6 grados).
| Tipo de molécula | Forma | Disposición electrónica† | Geometría‡ | Ejemplos |
|---|---|---|---|---|
| AB1En | Diatómica | HF, O2 | ||
| AB2E0 | Lineal | BeCl2, CO2 | ||
| AB2E1 | Angular | 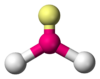 |
 |
SO2, O3 |
| AB2E2 | Angular |  |
H2O | |
| AB2E3 | Lineal | 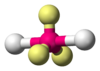 |
XeF2 | |
| AB3E0 | Triangular plana | 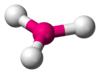 |
 |
BF3, CO32− |
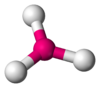
| AB3E1 | Pirámide trigonal |  |
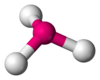 |
NH3, PCl3 |
| AB3E2 | Forma de T | 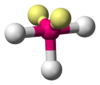 |
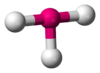 |
ClF3 |
| AB4E0 | Tetraédrica | 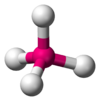 |
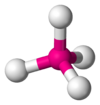 |
CH4, SO42− |
| AB4E1 | Balancín |  |
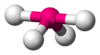 |
SF4 |
| AB4E2 | Cuadrada plana | 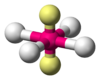 |
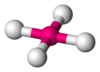 |
XeF4 |
| AB5E0 | Bipirámide trigonal | 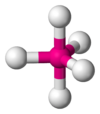 |
 |
PCl5 |
| AB5E1 | Pirámide cuadrada | 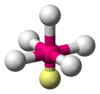 |
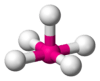 |
ClF5 |
| AB6E0 | Octaédrica | 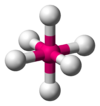 |
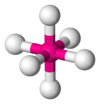 |
SF6 |
| AB7E0 | Bipirámide pentagonal | 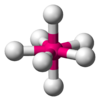 |
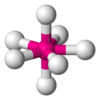 |
IF7 |
Excepciones a la TRePEV
Aunque la TRePEV es muy útil, hay algunos casos en los que sus predicciones no son exactas.
Compuestos de metales de transición
La TRePEV no siempre funciona bien para predecir las formas de los compuestos que contienen metales de transición. Esto se debe a que los electrones de las capas internas de estos metales pueden interactuar de maneras más complejas con los átomos vecinos, lo que la TRePEV no considera.
Véase también
 En inglés: VSEPR theory Facts for Kids
En inglés: VSEPR theory Facts for Kids