Difluoruro de xenón para niños
Datos para niños
Difluoruro de Xenón |
||
|---|---|---|
 |
||
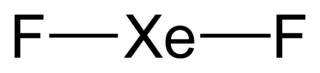 |
||
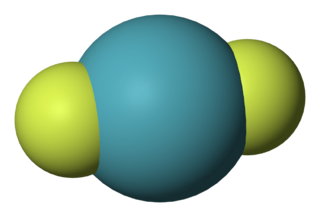 |
||
| Nombre IUPAC | ||
| Difluoruro de xenón Fluoruro de xenón (II) |
||
| General | ||
| Fórmula molecular | XeF2 | |
| Identificadores | ||
| Número CAS | 13709-36-9 | |
| ChemSpider | 75497 | |
| PubChem | 83674 | |
| UNII | 6POJ14981P | |
|
F[Xe]F
|
||
|
InChI
InChI=1S/F2Xe/c1-3-2
Key: IGELFKKMDLGCJO-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
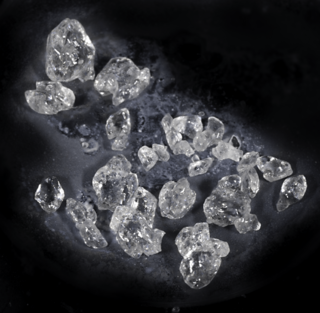
| Apariencia | Sólido blanco | |
| Densidad | 4320 kg/m³; 4,32 g/cm³ | |
| Masa molar | 169,29 g/mol | |
| Punto de fusión | 401,8 K (129 °C) | |
| Presión de vapor | 6,0 × 102 Pa | |
| Estructura cristalina | Paralelo linear | |
| Propiedades químicas | ||
| Solubilidad en agua | 25 g/L (0 °C) | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0sólido | -108 kJ/mol | |
| S0sólido | 254 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
1
OX
|
|
| Riesgos | ||
| Riesgos principales | Corrosivo para los tejidos expuestos. Libera compuestos tóxicos en contacto con la humedad. | |
| Más información | PELCHEM MSDS | |
| Compuestos relacionados | ||
| Otros compuestos | Tetrafluoruro de xenón Hexafluoruro de xenón |
|
| Otros cationes | Difluoruro de kriptón Difluoruro de radón |
|
| Otros aniones | Dicloruro de xenón | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El difluoruro de xenón (XeF2) es un compuesto químico muy interesante. Es conocido por ser un agente fluorante potente, lo que significa que puede añadir átomos de flúor a otras sustancias. Es uno de los compuestos de xenón más estables que existen.
El difluoruro de xenón es un sólido blanco y denso, con una fórmula química de XeF2. Es sensible a la humedad, lo que significa que reacciona con el agua. También se descompone si le da la luz, pero si se guarda correctamente, es bastante estable. Tiene un olor fuerte y no muy agradable.
Contenido
¿Cómo es la estructura del Difluoruro de Xenón?
El difluoruro de xenón tiene una forma lineal. Imagina que los átomos están en fila recta. La distancia entre el átomo de xenón y cada átomo de flúor es de aproximadamente 197.73 picómetros cuando está en estado de vapor.
A presiones muy altas, el difluoruro de xenón puede cambiar de forma. Por ejemplo, a unas 50 gigapascales de presión, se convierte en un semiconductor. Esto significa que puede conducir la electricidad, pero no tan bien como un metal. Aún más presión, por encima de 70 GPa, puede volverse metálico, lo que significa que conduce muy bien la electricidad.
Los enlaces entre el xenón y el flúor en el XeF2 no son muy fuertes. Sin embargo, el XeF2 es mucho más resistente que un compuesto similar llamado difluoruro de kriptón (KrF2).
¿Cómo se fabrica el Difluoruro de Xenón?
El difluoruro de xenón se puede crear con una reacción química sencilla:
- Xe + F2 → XeF2
Para que esta reacción ocurra, se necesita aplicar calor, luz o una descarga eléctrica. El resultado es un sólido que luego se purifica.
El primer informe público sobre el XeF2 fue en octubre de 1962. Sin embargo, se cree que fue creado por primera vez a principios de 1962 por Rudolf Hoppe en Alemania. Él hizo reaccionar gases de flúor y xenón usando una descarga eléctrica.
Más tarde, otros científicos lograron sintetizarlo usando luz ultravioleta o incluso la luz del sol. Se descubrió que si no se purificaba el flúor para quitarle el HF, la reacción era mucho más rápida. En 1965, también se logró fabricar haciendo reaccionar gas xenón con difluoruro de dioxígeno.
¿Se disuelve en otras sustancias?
El XeF2 puede disolverse en líquidos como el BrF5, BrF3 y HF sin cambiar su composición. Por ejemplo, se disuelve mucho en HF, hasta 167 gramos por cada 100 gramos de HF a casi 30 °C.
Otros compuestos de xenón
El difluoruro de xenón puede usarse para crear otros compuestos de xenón. Por ejemplo, se puede formar un compuesto inestable llamado Xe(CF3)2. También puede reaccionar con otras sustancias para formar iones como el XeF+.
¿Para qué se usa el Difluoruro de Xenón?
El difluoruro de xenón es muy útil en la química y la tecnología.
Como agente fluorante
Como ya mencionamos, el difluoruro de xenón es un agente fluorante muy potente. Esto significa que es excelente para añadir átomos de flúor a otras moléculas. Cuando se combina con ciertas sustancias, puede formar compuestos aún más potentes para fluorar.
El XeF2 es muy específico. Puede añadir flúor a ciertos átomos sin afectar otras partes de una molécula. Por ejemplo, puede fluorar el átomo de arsénico en la trimetilarsina, dejando intactos los grupos metilo. También se usa para crear sales de N-fluoroamonio, que son útiles en la química orgánica.
Además, el XeF2 puede ayudar a transformar ciertos ácidos carboxílicos en fluoroalcanos, liberando dióxido de carbono. Se ha descubierto que el tetrafluoruro de silicio puede acelerar estas reacciones de fluoración.
Como grabador químico
El difluoruro de xenón también se utiliza para "grabar" o quitar capas de silicio en la fabricación de sistemas microelectromecánicos (MEMS). Piensa en ello como una herramienta muy precisa para esculpir materiales a una escala muy pequeña.
El proceso funciona así: el XeF2 se adhiere a la superficie del silicio y se divide en xenón y flúor. El flúor es el que realmente "graba" el silicio. La reacción es:
- 2 XeF2 + Si → 2 Xe + SiF4
Una ventaja del XeF2 es que graba el silicio de manera uniforme y no necesita otras fuentes de energía, como bombardeo de iones.
Véase también
 En inglés: Xenon difluoride Facts for Kids
En inglés: Xenon difluoride Facts for Kids


