Sulfuro de carbono para niños
Datos para niños
Sulfuro de carbono |
||
|---|---|---|
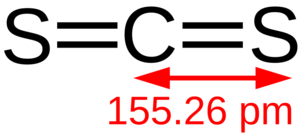 Estructura molecular.
|
||
 Estructura tridimensional.
|
||
| Nombre IUPAC | ||
| Disulfuro de carbono | ||
| General | ||
| Fórmula molecular | CS2 | |
| Identificadores | ||
| Número CAS | 75-15-0 | |
| Número RTECS | FF6650000 | |
| ChEBI | 23012 | |
| ChEMBL | CHEMBL1365180 | |
| ChemSpider | 6108 | |
| PubChem | 6348 | |
| UNII | S54S8B99E8 | |
| KEGG | C19033 | |
|
InChI
InChI=InChI=1S/CS2/c2-1-3
Key: QGJOPFRUJISHPQ-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro (puro) Líquido amarillento (impuro) |
|
| Densidad | 1263 kg/m³; 1,263 g/cm³ | |
| Masa molar | 76,131 g/mol | |
| Punto de fusión | 162,15 K (−111 °C) | |
| Punto de ebullición | 319,15 K (46 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Ligeramente soluble en agua 0,1185 g/100 ml |
|
| Peligrosidad | ||
| SGA |    |
|
| Riesgos | ||
| Ingestión | Confusión mental, vértigo, somnolencia, dolor de cabeza, náuseas, hiperventilación, vómitos, debilidad, irritabilidad y alucinaciones. | |
| Inhalación | Confusión mental, vértigo, somnolencia, dolor de cabeza, náuseas, hiperventilación, vómitos, debilidad, irritabilidad y alucinaciones. | |
| Piel | Puede absorberse. Piel seca, enrojecimiento. | |
| Ojos | Enrojecimiento, dolor. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfuro de carbono o disulfuro de carbono (CS2) es un líquido que se evapora fácilmente. Es incoloro y se enciende con mucha facilidad. Tiene un olor particular que se vuelve más fuerte si no está puro. Esto ocurre porque se descompone y libera ácido sulfhídrico, que huele a huevos podridos.
Este compuesto se mezcla muy bien con la mayoría de los líquidos orgánicos. También puede disolver sustancias como el yodo, el azufre y el fósforo blanco.
Contenido
¿Cómo se obtiene el sulfuro de carbono?
Fabricación en la industria
El sulfuro de carbono se produce combinando directamente azufre en forma de vapor y carbono. Esta reacción se realiza sin aire y a temperaturas muy altas, entre 800 y 1000 grados Celsius.
C (s) + S2 (g) → CS2
Formación natural
En la naturaleza, el sulfuro de carbono puede aparecer en algunos procesos donde la materia orgánica se descompone sin oxígeno.
Reacciones químicas del sulfuro de carbono
Reacción con agua
Cuando el sulfuro de carbono entra en contacto con agua, se descompone lentamente. Forma otras sustancias como el sulfuro de carbonilo, dióxido de carbono y ácido sulfhídrico.
Reacción con bases
Si el sulfuro de carbono reacciona con sustancias llamadas bases, como el hidróxido de sodio, se forman compuestos conocidos como xantogenatos.
- CS2 + NaOH → NaOC(=S)S
Usos y aplicaciones del sulfuro de carbono
En la fabricación de fibras
La mayor parte del sulfuro de carbono se usa para producir fibras de celulosa. Por ejemplo, se emplea en la fabricación de rayón, una fibra artificial. Con la ayuda de sosa, el sulfuro de carbono transforma la celulosa en xantogenatos, que son solubles. Luego, estos se pasan por unos pequeños orificios y se solidifican para formar las fibras.
Otros usos importantes
- Los xantogenatos de cobre se han utilizado para controlar plagas.
- En química, el sulfuro de carbono se usa a veces como disolvente en una técnica llamada espectroscopia de infrarrojo. Es útil porque no interfiere con las mediciones de otras sustancias.
- Es un material de partida para crear tetratiofulvalenos. Estos compuestos son importantes porque se usan como semiconductores orgánicos en la electrónica.
- Los productos que se forman al reaccionar el sulfuro de carbono con aminas, llamados ditiocarbamatos, son útiles en el proceso de vulcanización del caucho.
- Históricamente, el fósforo blanco disuelto en sulfuro de carbono se usó en la fabricación de ciertos artefactos incendiarios.
- En el pasado, se empleó mucho en la industria para extraer aceite de orujo, especialmente para hacer jabón. Esto se debía a su capacidad para disolver grasas. Sin embargo, debido a su alta inflamabilidad, fue reemplazado por otros disolventes.
Efectos en la salud
La exposición prolongada a los vapores de sulfuro de carbono puede causar problemas de salud. Los síntomas pueden incluir confusión, mareos, somnolencia, dolor de cabeza, náuseas y vómitos. También puede provocar debilidad e irritabilidad.
Si la exposición es continua, puede causar dolores de cabeza, problemas para dormir y dificultades con la vista, la memoria y el oído. También puede afectar los nervios y los vasos sanguíneos. Se han reportado daños en el hígado.
En estudios con animales, la exposición a este compuesto ha mostrado efectos en el desarrollo de las crías.
A niveles muy altos, el sulfuro de carbono puede ser muy peligroso para la vida. Esto se debe a sus efectos sobre el sistema nervioso. Gran parte de la información sobre su seguridad proviene de la industria del rayón viscoso, donde este compuesto y pequeñas cantidades de ácido sulfhídrico pueden estar presentes.
Véase también
 En inglés: Carbon disulfide Facts for Kids
En inglés: Carbon disulfide Facts for Kids

