Plaqueta para niños
Datos para niños Plaquetas |
||
|---|---|---|
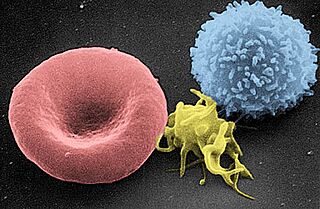 Imagen tomada con un microscopio electrónico de barrido en la que se observa, de izquierda a derecha: un glóbulo rojo, una plaqueta y un glóbulo blanco.
|
||
Representación 3D de varias plaquetas, algunas activadas (activated platelets).
|
||
| Nombre y clasificación | ||
| Sinónimos |
|
|
| Latín | Thrombocytus | |
| TH | H2.00.04.1.03001 | |
| Información anatómica | ||
| Sistema | Circulatorio | |
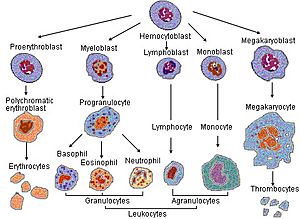
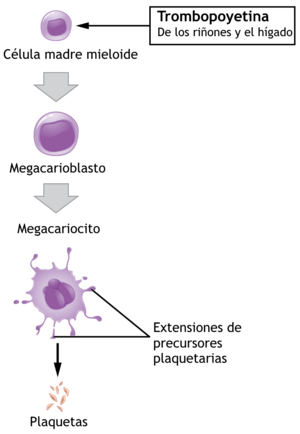
| Precursor | Megacariocito | |
|
|
||
Las plaquetas, también conocidas como trombocitos, son partes muy pequeñas de células que se encuentran en nuestra sangre. No tienen núcleo y miden entre 2 y 3 micrómetros de diámetro. Se forman a partir de células más grandes llamadas megacariocitos. Una plaqueta vive en la sangre entre 8 y 11 días.
Las plaquetas son muy importantes para detener las hemorragias. Cuando te haces un corte, ellas ayudan a formar un "tapón" o coágulo para cerrar la herida. También son una fuente natural de sustancias que ayudan a que los tejidos se reparen. Las plaquetas circulan en la sangre de todos los mamíferos, incluyendo a los humanos.
Si tienes muy pocas plaquetas, puedes sangrar más de lo normal. Si tienes demasiadas, se pueden formar coágulos que podrían bloquear los vasos sanguíneos. Esto podría causar problemas graves como un accidente cerebrovascular o un infarto agudo de miocardio. Cualquier problema con las plaquetas se llama trombocitopatía. Esto puede ser tener pocas plaquetas (trombocitopenia), que no funcionen bien (tromboastenia), o tener muchas (trombocitosis).
Las plaquetas liberan muchas sustancias que ayudan a la curación. Por ejemplo, liberan factores de crecimiento que son importantes para reparar los tejidos dañados. Estos factores ayudan a que las células crezcan y se reparen. Por eso, a veces se usa un tratamiento llamado plasma rico en plaquetas (PRP) para ayudar a curar lesiones.
Contenido
¿Quién descubrió las plaquetas?
Los primeros científicos en describir las plaquetas fueron el biólogo francés Alfred Donné y los médicos ingleses George Gulliver y William Addison. En 1865, el anatomista alemán Max Schultze publicó una descripción de las plaquetas mientras estudiaba los glóbulos blancos. Él las llamó "esférulas" y notó que a veces se agrupaban.
Más tarde, Giulio Bizzozero (1846-1901) estudió las células sanguíneas en animales vivos. Él observó que las plaquetas se juntaban en el lugar de una herida en los vasos sanguíneos. Esta observación confirmó que las plaquetas son clave para la coagulación de la sangre.
¿Cómo se producen las plaquetas?
- Las plaquetas se producen en la médula ósea a partir de células grandes llamadas megacariocitos. Este proceso se llama trombopoyesis.
- Un adulto sano produce alrededor de 100 mil millones de plaquetas cada día.
- Las plaquetas viven entre 8 y 12 días en la sangre.
- La producción de plaquetas está controlada por una hormona llamada trombopoyetina. Esta hormona se produce principalmente en el hígado y los riñones.
- Cada megacariocito puede producir entre 5,000 y 10,000 plaquetas.
- Las plaquetas viejas son eliminadas por el bazo y el hígado.
- Una parte de las plaquetas se guarda en el bazo y se libera cuando el cuerpo las necesita.
¿Cómo detienen las plaquetas una hemorragia?
La función principal de las plaquetas es mantener nuestro sistema circulatorio funcionando correctamente. Lo hacen formando coágulos cuando un vaso sanguíneo se daña. Si no hay daño, las plaquetas no forman coágulos.
Activación de las plaquetas
Los vasos sanguíneos están cubiertos por una capa de células llamadas endotelio. Normalmente, estas células evitan que las plaquetas se activen. Pero si el endotelio se daña, se exponen sustancias como el colágeno y el factor de von Willebrand (FvW).
Cuando las plaquetas entran en contacto con el colágeno o el FvW, se activan. También pueden activarse por una sustancia llamada trombina.
Cambio de forma y secreción
Una vez activadas, las plaquetas cambian su forma, volviéndose más redondas y desarrollando "brazos" llamados pseudopodos. Esto les da una forma de estrella.
Las plaquetas activadas liberan el contenido de unos pequeños sacos que tienen dentro, llamados gránulos. Estos gránulos contienen sustancias importantes como:
- Gránulos densos: Contienen ADP, ATP, calcio y serotonina.
- Gránulos-α: Contienen factores de crecimiento y otras proteínas que ayudan a la coagulación y reparación.
Adhesión y unión
Las plaquetas activadas se pegan al colágeno expuesto en la herida. Luego, se unen entre sí para formar un tapón plaquetario. Esta unión se llama agregación. Sustancias como el ADP y el tromboxano A2 estimulan esta unión.
Reparación de heridas
El coágulo de sangre es una solución temporal para detener el sangrado. Después, el vaso sanguíneo debe repararse. Las plaquetas ayudan en este proceso liberando sustancias químicas que atraen a otras células para formar una costra. Con el tiempo, el coágulo se disuelve y las plaquetas son eliminadas.
Otras funciones de las plaquetas
Además de detener hemorragias, las plaquetas tienen otras funciones:
- Ayudan a que el coágulo se haga más pequeño.
- Participan en la inflamación del cuerpo.
- Envían señales a otras células.
- Pueden "comer" o eliminar partículas extrañas (fagocitosis).
Señales para el cuerpo
Las plaquetas no solo detienen el sangrado. También llegan rápidamente a los lugares donde hay una lesión o infección. Allí, pueden influir en cómo el cuerpo responde a la inflamación, interactuando con otras células de la sangre y liberando sustancias que actúan como mensajeros.
Plaquetas y enfermedades
Cantidad de plaquetas: ¿normal, alta o baja?
Una persona sana suele tener entre 150,000 y 450,000 plaquetas por microlitro de sangre. Si el número es muy alto o muy bajo, puede indicar un problema de salud.
- Pocas plaquetas (trombocitopenia): Aumenta el riesgo de sangrado.
- Muchas plaquetas (trombocitosis): Puede aumentar el riesgo de que se formen coágulos.
A veces, aunque el número de plaquetas sea normal, no funcionan correctamente. Por ejemplo, algunos medicamentos como el ácido acetilsalicílico (aspirina) pueden afectar la función de las plaquetas, haciendo que la sangre tarde más en coagular.
Medicamentos que afectan las plaquetas
Algunos medicamentos se usan para cambiar o reducir la función de las plaquetas, especialmente para prevenir coágulos.
- Medicamentos orales comunes: Ácido acetilsalicílico, Clopidogrel.
- Medicamentos intravenosos comunes: Abciximab, Eptifibatida.
Enfermedades relacionadas con las plaquetas
- Enfermedades con pocas plaquetas:
- Trombocitopenia (generalmente)
- Púrpura trombocitopénica idiopática (PTI)
- Anemia aplásica
- Enfermedades con muchas plaquetas:
- Trombocitosis (puede ser una respuesta del cuerpo o un trastorno)
- Enfermedades donde las plaquetas no funcionan bien:
- Síndrome de Bernard-Soulier
- Tromboastenia de Glanzmann
- Enfermedad de von Willebrand
- Enfermedades donde las plaquetas juegan un papel importante:
- Aterosclerosis (endurecimiento de las arterias)
- Enfermedad coronaria (problemas del corazón)
- Accidente cerebrovascular (problemas en el cerebro por falta de sangre)
- Cáncer
Un estudio reciente encontró que algunas variaciones genéticas en las plaquetas pueden estar relacionadas con el desarrollo de la ateroesclerosis. Por ejemplo, cambios en los genes PEAR1 y RGS18 pueden influir en cómo las plaquetas se agrupan y en el riesgo de formar coágulos.
¿Qué es el plasma rico en plaquetas (PRP)?
El plasma rico en plaquetas (PRP) es un tratamiento que usa la propia sangre del paciente para ayudar a curar lesiones. Para prepararlo, se extrae una pequeña cantidad de sangre. Luego, se separan las plaquetas y el plasma de los otros componentes de la sangre. Finalmente, se concentra el plasma con las plaquetas para formar un gel.
Este gel de PRP se puede aplicar en la zona de la lesión. Las plaquetas activadas en el PRP liberan muchos factores de crecimiento. Estos factores son muy importantes para regular y estimular el proceso de curación de los tejidos.
Existen diferentes métodos para preparar el PRP. Algunos usan sustancias para activar las plaquetas, mientras que otros solo usan la centrifugación. La idea es que los factores de crecimiento se liberen de forma gradual en el lugar de la lesión, ayudando a la recuperación.
Véase también
 En inglés: Platelet Facts for Kids
En inglés: Platelet Facts for Kids