Ligando para niños
En química, un ligando es una molécula o un ion que se une a un átomo de metal en el centro. Juntos, forman lo que se llama un complejo de coordinación. Piensa en el átomo de metal como el "corazón" del complejo y los ligandos como los "brazos" que se unen a él.
La unión entre el metal y el ligando ocurre porque el ligando suele donar uno o más pares de electrones al átomo de metal. Esta unión puede ser fuerte o más suave, y a veces, el ligando puede unirse al metal de varias maneras. Los ligandos son como "bases de Lewis", lo que significa que son buenos donando electrones.
Algunos ligandos son muy sencillos, como el agua o el cloruro. Estos solo tienen un punto para unirse al metal y se llaman ligandos monodentados. Otros ligandos tienen varios puntos de unión y se conocen como ligandos polidentados o agentes quelantes. También existen los ligandos ambidentados, que pueden unirse de dos maneras diferentes, aunque solo usen una a la vez.
Para que una molécula o ion sea un ligando, debe tener átomos con al menos un par de electrones que no estén compartidos. Estos átomos suelen ser oxígeno, nitrógeno, carbono, fósforo, azufre, cloro o flúor.
Contenido
¿Qué es un Ligando en Química?
Un ligando es una parte clave en la formación de los complejos de coordinación. Estos complejos son muy importantes en la química y en la biología. Por ejemplo, la hemoglobina en nuestra sangre, que transporta oxígeno, es un complejo de coordinación con un átomo de hierro en el centro y ligandos a su alrededor.
Los ligandos pueden clasificarse de muchas maneras. Se pueden agrupar por su tipo químico, por cuántos puntos de unión tienen, por su carga eléctrica o por cómo se unen al metal.
¿Cómo se unen los Ligandos al Metal?
La unión entre un ligando y un metal es como un "abrazo" químico. El ligando ofrece sus electrones al metal, y el metal los acepta. Esta donación de electrones es lo que forma el enlace. Dependiendo de los átomos involucrados, este enlace puede ser más parecido a compartir electrones (covalente) o a una atracción entre cargas opuestas (iónico).
Tipos de Ligandos según cuántos "dientes" tienen (Denticidad)
La "denticidad" de un ligando se refiere a cuántos puntos de unión tiene para conectarse al átomo de metal central. Es como si el ligando tuviera "dientes" para agarrarse.
Ligandos Monodentados: Un solo "diente"
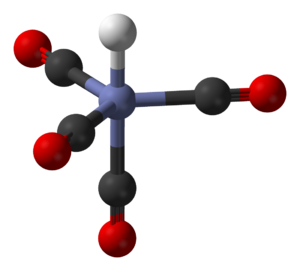
Estos ligandos tienen un único punto de unión al átomo de metal. La palabra "monodentado" significa "un solo diente". Suelen ser moléculas pequeñas con un solo átomo que dona electrones. Algunos ejemplos son el amoníaco (NH3), el agua (H2O) o los iones cloruro (Cl-).
Cuando estos ligandos se unen a un ion metálico, pueden cambiar cómo se disuelve ese ion en un líquido. Generalmente, el complejo se hace más grande, lo que puede hacer que el ion se disuelva mejor o que sea menos propenso a formar un sólido y precipitar.
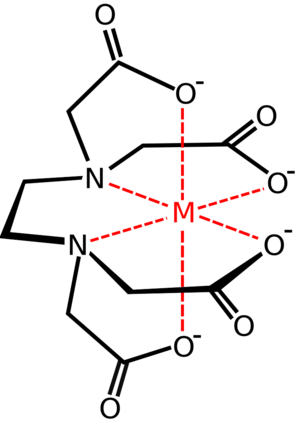
Ligandos Polidentados o Agentes Quelantes: ¡Muchas "pinzas"!
Los ligandos polidentados pueden unirse al átomo de metal en dos o más puntos al mismo tiempo. Se les llama "bidentados" si tienen dos puntos, "tridentados" si tienen tres, y así sucesivamente. También se les conoce como "agentes quelantes". La palabra "quelante" viene del griego "kela", que significa "pinza". Esto es porque la estructura que forman se parece a un cangrejo atrapando el átomo de metal con sus pinzas.
Los agentes quelantes son muy útiles. A veces se usan para hacer que las sustancias se separen de una solución, porque al unirse a varios metales, pueden formar grandes grupos que se asientan fácilmente.
Un ejemplo importante es el EDTA, que es un ligando polidentado muy grande con seis puntos de unión. Otros ejemplos incluyen los iones fosfato (PO43-) y oxalato (-OOC-COO-).
Ligandos Ambidentados: Un "diente" con opciones
Estos ligandos son un caso especial. Tienen más de un átomo que podría donar electrones, pero son demasiado pequeños para usar ambos a la vez. En cambio, se unen de una forma u otra, dependiendo de las condiciones. Por ejemplo, el ion tiocianato (S=C=N-) puede unirse al metal a través del azufre o a través del nitrógeno.
Otros Tipos de Ligandos
Los ligandos también se pueden clasificar por otras características, como cuántos de sus átomos conectados se unen al metal o cómo comparten los electrones.
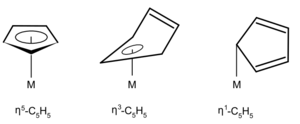
Ligandos según su Hapticidad: ¿Cuántos átomos se unen?
La hapticidad nos dice cuántos átomos seguidos de un ligando están unidos al átomo de metal central. Se usa la letra griega eta (η) para indicarlo. Si solo un átomo se une, la hapticidad es 1. Por ejemplo, una molécula como el butadieno puede unirse al metal con dos de sus átomos de carbono (η2) o con cuatro (η4).
Ligandos según cómo comparten electrones
Los ligandos también se diferencian por cómo interactúan con los electrones del metal:
- Ligandos que donan electrones fuertemente: Son muy "electronegativos" y tienen muchos electrones. Ayudan a que los metales con pocos electrones (en "altos estados de oxidación") sean muy estables. Ejemplos son los halogenuros (como el cloruro) y el óxido.
- Ligandos que solo donan electrones de una forma simple: Estos son importantes para estabilizar ciertos metales. Ejemplos son el agua (H2O) y el amoníaco (NH3).
- Ligandos que donan y aceptan electrones: Estos ligandos ayudan a estabilizar metales que tienen muchos electrones (en "bajos estados de oxidación"). El metal puede donar electrones al ligando, y el ligando también puede donar al metal. Ejemplos son el monóxido de carbono (CO) y los cianuros.
- Complejos con nubes de electrones: En este caso, la unión se da con una "nube" de electrones que tiene el ligando, no con un solo átomo. Esto ocurre con moléculas que tienen enlaces especiales llamados "enlaces pi". Un ejemplo es el etileno.
Véase también
 En inglés: Ligand Facts for Kids
En inglés: Ligand Facts for Kids
- Ligando (bioquímica)
- Agente quelante
- Teoría del campo de los ligandos