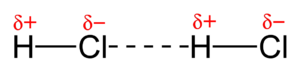Fuerza intermolecular para niños
Las fuerzas intermoleculares son las atracciones que existen entre las moléculas. Estas fuerzas son diferentes de los enlaces químicos que mantienen unidos a los átomos dentro de una misma molécula.
Imagina que las moléculas son como pequeños imanes. Los enlaces químicos son como el pegamento que une las piezas de un juguete, mientras que las fuerzas intermoleculares son como la atracción débil que sientes cuando acercas dos juguetes.
Existen varios tipos de fuerzas intermoleculares, y se clasifican según cómo interactúan las moléculas:
- El enlace de hidrógeno.
- Las fuerzas de Van der Waals, que incluyen:
* Interacciones ion-dipolo. * Interacciones dipolo-dipolo. * Interacciones dipolo-dipolo inducido. * Las Fuerzas de dispersión de London, también llamadas dipolo instantáneo-dipolo inducido.
Estas interacciones son mucho más débiles que los enlaces químicos que forman las moléculas.
Contenido
- Historia de las fuerzas intermoleculares
- Enlace de hidrógeno
- Fuerzas de Van der Waals
- Atracciones dipolo-dipolo
- Interacciones iónicas
- Fuerzas de London o de dispersión
- Fuerzas ion-dipolo
- Efecto de las fuerzas intermoleculares en propiedades físicas y químicas
- Aportaciones de las fuerzas intermoleculares
- Véase también
Historia de las fuerzas intermoleculares
En 1967, un químico francés llamado Jean-Marie Lehn desarrolló la química supramolecular. Esta rama de la química estudia cómo las moléculas se unen entre sí usando interacciones débiles, como los enlaces de hidrógeno y las fuerzas de Van der Waals. Es como una extensión de la química tradicional, que se enfoca en cómo los átomos se unen para formar moléculas. La química supramolecular se enfoca en cómo las moléculas se unen para formar estructuras más grandes.
Aunque las fuerzas intermoleculares son débiles, son muy importantes en muchos procesos. Por ejemplo, en la biología, procesos fundamentales como la forma en que las proteínas funcionan o cómo se copia el ADN dependen de estas fuerzas. La química supramolecular se inspiró mucho en cómo funcionan los sistemas biológicos.
Enlace de hidrógeno
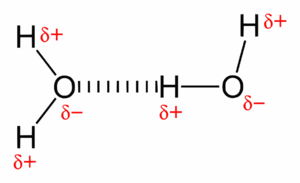
El enlace de hidrógeno ocurre cuando un átomo de hidrógeno está unido a un átomo muy electronegativo, como el nitrógeno, el oxígeno o el flúor. El átomo de hidrógeno, al estar unido a uno de estos elementos, adquiere una pequeña carga positiva. Esta carga positiva puede atraerse a otro átomo electronegativo (N, O o F) de otra molécula.
Un ejemplo muy claro de enlace de hidrógeno es el agua. Las moléculas de agua se unen entre sí mediante enlaces de hidrógeno, lo que le da al agua muchas de sus propiedades especiales, que son esenciales para la vida en la Tierra.
Los enlaces de hidrógeno también son cruciales en la naturaleza. Por ejemplo, son los que mantienen unidas las dos cadenas de una molécula de ADN, que es donde se guarda la herencia genética de todos los seres vivos.
La energía de un enlace de hidrógeno es bastante fuerte para ser una interacción intermolecular (más de 40 KJ/mol). Esto hace que sea muy importante para la forma y las propiedades de muchos compuestos.
Una prueba de la importancia de los enlaces de hidrógeno se ve en los puntos de ebullición. Normalmente, los compuestos más pesados tienen puntos de ebullición más altos. Sin embargo, el agua (H2O), el amoníaco (NH3) y el fluoruro de hidrógeno (HF) tienen puntos de ebullición más altos de lo esperado para su tamaño. Esto se debe a los fuertes enlaces de hidrógeno que forman sus moléculas, que requieren más energía para separarse y pasar al estado de vapor.
Fuerzas de Van der Waals
Las fuerzas de Van der Waals, también conocidas como fuerzas de dispersión o de London, son interacciones que ocurren entre moléculas que no tienen una carga eléctrica permanente. Se producen porque los electrones de una molécula están en constante movimiento. En un momento dado, puede haber más electrones en una parte de la molécula que en otra, creando un pequeño desequilibrio de carga, un "dipolo momentáneo".
Cuando dos de estas moléculas con dipolos momentáneos se acercan, pueden atraerse entre sí. Estas fuerzas son muy débiles y se hacen más fuertes a medida que las moléculas son más grandes, porque tienen más electrones que pueden moverse y crear estos dipolos temporales.
Atracciones dipolo-dipolo
Las atracciones dipolo-dipolo son interacciones que ocurren entre dos moléculas que son polares, es decir, que tienen un extremo con una carga positiva parcial y otro extremo con una carga negativa parcial de forma permanente. Estas moléculas se atraen cuando la parte positiva de una se acerca a la parte negativa de la otra.
Son como pequeños imanes permanentes que se atraen. Cuanto más fuertes sean estas cargas parciales (mayor sea el momento dipolar), más fuerte será la atracción. Un ejemplo es el ácido clorhídrico (HCl), donde el hidrógeno tiene una carga parcial positiva y el cloro una carga parcial negativa.
Interacciones iónicas
Las interacciones iónicas ocurren entre iones con cargas opuestas, como un catión (carga positiva) y un anión (carga negativa). Estas fuerzas son muy fuertes y se deben a la atracción eléctrica entre las cargas opuestas.
Un ejemplo de esto se ve en las proteínas, donde las partes con carga positiva y negativa de diferentes aminoácidos pueden atraerse entre sí, ayudando a dar forma a la proteína.
Fuerzas de London o de dispersión
Las fuerzas de London están presentes en todas las sustancias moleculares, incluso en aquellas que no son polares, como los gases nobles o el oxígeno. Son el resultado de la atracción entre los extremos positivo y negativo de "dipolos inducidos" en moléculas cercanas.
Un dipolo inducido se forma cuando los electrones de una molécula se mueven y, por un instante, crean un desequilibrio de carga. Este desequilibrio puede "inducir" un desequilibrio similar en una molécula vecina, creando una atracción temporal.
La fuerza de estas interacciones depende de qué tan fácil sea mover los electrones de una molécula. Las moléculas más grandes, con más electrones, son más fáciles de polarizar y, por lo tanto, tienen fuerzas de London más fuertes. Esto explica por qué los puntos de ebullición de las moléculas no polares aumentan con su tamaño.
Fuerzas ion-dipolo
Estas interacciones ocurren entre un ion (una partícula con carga eléctrica) y una molécula polar neutra (un dipolo). Los iones positivos son atraídos por el extremo negativo del dipolo, y los iones negativos son atraídos por el extremo positivo.
Las fuerzas ion-dipolo son muy importantes en las soluciones. Por ejemplo, cuando la sal (un compuesto iónico) se disuelve en agua, las moléculas de agua (que son dipolos) rodean y atraen a los iones de la sal, ayudando a que se disuelvan. Este proceso se llama hidratación.
Efecto de las fuerzas intermoleculares en propiedades físicas y químicas
Las fuerzas intermoleculares son clave para entender muchas propiedades de las sustancias. Como estas fuerzas actúan entre millones de moléculas, influyen en cómo se comportan los materiales.
Algunas propiedades que dependen de las fuerzas intermoleculares son:
- Estado de la materia: Si una sustancia es sólida, líquida o gaseosa a cierta temperatura.
- Punto de fusión: La temperatura a la que un sólido se convierte en líquido.
- Punto de ebullición: La temperatura a la que un líquido se convierte en gas.
- Solubilidad: Qué tan bien una sustancia se disuelve en otra.
- Densidad: Cuánta masa hay en un volumen determinado.
- Viscosidad: Qué tan "espeso" es un líquido (su resistencia a fluir).
En general, cuanto más fuertes son las fuerzas intermoleculares, más energía se necesita para separar las moléculas, lo que resulta en puntos de fusión y ebullición más altos.
Aportaciones de las fuerzas intermoleculares
El estudio de las fuerzas intermoleculares ha permitido avances importantes en la ciencia y la tecnología, especialmente en el campo de la medicina.
Obtención de células especiales
Científicos han descubierto formas de obtener células madre que pueden convertirse en diferentes tipos de células del cuerpo. Esto es muy útil para estudiar enfermedades y desarrollar terapias, por ejemplo, para tratar tumores o problemas del sistema inmunológico. Este método implica insertar proteínas en las células, y las interacciones intermoleculares ayudan a que estas células vuelvan a un estado más primitivo, lo que permite que se usen para diferentes propósitos.
Manipulación de proteínas para la piel
Se ha investigado cómo una proteína llamada IL-21 podría ayudar a prevenir problemas de la piel como los eczemas. Al entender y manipular las interacciones de esta proteína, los científicos buscan nuevas formas de tratamiento. Aunque las investigaciones aún están en curso, el conocimiento de las fuerzas intermoleculares es fundamental para estos estudios.
Proteínas y la vida
Investigadores han estudiado las proteínas en animales como las ratas topo, que son conocidas por su larga vida. Han descubierto que las proteínas de estos animales son muy precisas y tienen pocos errores. Esto es importante porque las proteínas sin errores ayudan al cuerpo a funcionar de manera más eficiente. El estudio de cómo se forman y funcionan estas proteínas, lo cual depende de las fuerzas intermoleculares, podría dar pistas sobre la longevidad.
Nuevas formas artificiales
La Biología sintética es un campo que busca diseñar y construir sistemas biológicos que no existen en la naturaleza. Esto podría permitir, por ejemplo, corregir defectos genéticos que causan enfermedades hereditarias. Al entender cómo las fuerzas intermoleculares controlan la forma y función de las moléculas biológicas, los científicos pueden trabajar en la creación de sistemas vivos con funciones específicas.
Véase también
 En inglés: Intermolecular force Facts for Kids
En inglés: Intermolecular force Facts for Kids
- Fuerzas de cohesión: Fuerzas de atracción entre moléculas del mismo tipo.
- Fuerzas de adhesión: Fuerzas de atracción entre moléculas de diferentes tipos.
- Enlace intermolecular
- Enlace químico
- Química supramolecular