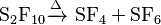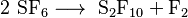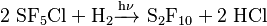Decafluoruro de diazufre para niños
Datos para niños
Decafluoruro de diazufre |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Decafluoruro de diazufre | ||
| General | ||
| Otros nombres | Decafluoruro de disulfuro Decasulfuro-1λ6,2λ6-disulfano |
|
| Fórmula molecular | S2F10 | |
| Identificadores | ||
| Número CAS | 5714-22-7 | |
| ChemSpider | 56348 | |
| PubChem | 62586 | |
|
InChI
InChI=InChI=1S/F10S2/c1-11(2,3,4,5)12(6,7,8,9)10
Key: BPFZRKQDXVZTFD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 2080 kg/m³; 2,08 g/cm³ | |
| Masa molar | 254,1 g/mol | |
| Punto de fusión | 220 K (−53 °C) | |
| Punto de ebullición | 303 K (30 °C) | |
| Presión de vapor | 561 mmHg | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
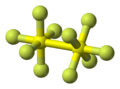
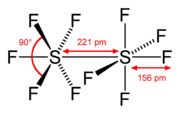
El decafluoruro de diazufre (S2F10) es un compuesto químico inorgánico. Fue descubierto en 1934 por los científicos Denbigh y Whytlaw-Gray. En su estructura, cada átomo de azufre está rodeado por cinco átomos de flúor, formando una figura parecida a un octaedro. También se le conoce como decafluoruro de disulfuro.
Contenido
¿Qué es el Decafluoruro de Diazufre?
El decafluoruro de diazufre es un líquido sin color. Tiene un olor que recuerda al fósforo quemado o al dióxido de azufre. Es una sustancia muy peligrosa y tóxica.
Este compuesto se forma cuando el hexafluoruro de azufre (SF6) se descompone por electricidad. El hexafluoruro de azufre es un material que se usa para aislar en sistemas de alto voltaje, como las líneas de electricidad. El S2F10 también se produce durante la fabricación del SF6, pero luego se separa.
¿Cómo se comporta este compuesto?
El decafluoruro de diazufre es un compuesto estable. Sin embargo, si se calienta a más de 150 °C, se descompone. Al descomponerse, forma hexafluoruro de azufre y tetrafluoruro de azufre. Esta reacción es útil para eliminar el S2F10 cuando se está fabricando SF6.
La reacción de descomposición se ve así:
¿Cómo se produce el Decafluoruro de Diazufre?
Principalmente, el decafluoruro de diazufre se produce a partir de la descomposición del hexafluoruro de azufre.
La reacción es la siguiente:
También puede formarse como un producto secundario cuando el azufre reacciona con el flúor. Otra forma de producirlo es mediante procesos fotoquímicos (usando luz) a partir del cloropentafluoruro de azufre.
Un ejemplo de esta reacción es:
¿Cómo es la estructura del Decafluoruro de Diazufre?
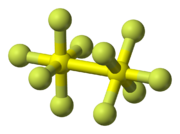
El S2F10 es una molécula. Está formada por dos grupos llamados SF5, que tienen forma de octaedro. Estos dos grupos están unidos entre sí por un enlace entre los dos átomos de azufre.
La forma de la molécula es muy específica. Los dos grupos SF5 están girados 45° uno respecto al otro a lo largo del enlace S-S. Los estudios científicos indican que es difícil que este enlace S-S gire a temperatura ambiente.
¿Cómo reacciona el Decafluoruro de Diazufre?
A temperatura ambiente, el S2F10 no es muy reactivo. Pero si se calienta, el enlace entre los dos átomos de azufre se rompe. Esto crea unas partes llamadas "radicales ·SF5", que pueden participar en diferentes reacciones.
Por ejemplo, el S2F10 puede reaccionar con:
- Cloro para formar SF5Cl:
- <chem>S2F10 + Cl2 -> 2SF5Cl</chem>
- Bromo para formar SF5Br:
- <chem>S2F10 + Br2 -> 2SF5Br</chem>
- Tetrafluorohidrazina para formar SF5NF2:
- <chem>S2F10 + N2F4 -> 2SF5NF2</chem>
Cuando el decafluoruro de diazufre está en agua, no se descompone fácilmente. Sin embargo, si está en presencia de hidróxido de sodio (una sustancia química fuerte), se descompone lentamente.
Galería de imágenes
Véase también
 En inglés: Disulfur decafluoride Facts for Kids
En inglés: Disulfur decafluoride Facts for Kids