Cloruro de carbono(IV) para niños
Datos para niños
Cloruro de carbono(IV) |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Tetracloruro de carbono(IV) Tetracloruro de carbono Tetraclorometano |
||
| General | ||
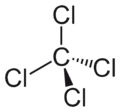
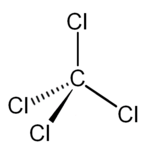
| Fórmula semidesarrollada | CCl4 | |
| Fórmula estructural | 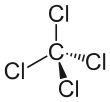 |
|
| Fórmula molecular | CCl4 | |
| Identificadores | ||
| Número CAS | 56-23-5 | |
| Número RTECS | FG4900000 | |
| ChEBI | 27385 | |
| ChEMBL | CHEMBL44814 | |
| ChemSpider | 5730 | |
| PubChem | 5943 | |
| UNII | CL2T97X0V0 | |
| KEGG | C07561 | |
|
InChI
InChI=InChI=1S/CCl4/c2-1(3,4)5
Key: VZGDMQKNWNREIO-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 1595 kg/m³; 1,595 g/cm³ | |
| Masa molar | 153,8 g/mol | |
| Punto de fusión | 250 K (−23 °C) | |
| Punto de ebullición | 350 K (77 °C) | |
| Temperatura crítica | 556 K (283 °C) | |
| Presión crítica | 55 atm | |
| Índice de refracción (nD) | 1,4607 | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.08 g/100 g de agua | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | -95.5 kJ/mol | |
| ΔfH0líquido | -128 kJ/mol | |
| ΔfH0sólido | -130 kJ/mol | |
| S0gas, 1 bar | 309.7 J·mol–1·K | |
| S0líquido, 1 bar | 216 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
|
|
| Riesgos | ||
| Ingestión | Muy peligroso, a largo plazo puede dañar el cerebro. | |
| Inhalación | Muy peligroso, a largo plazo puede dañar el cerebro. | |
| Piel | Puede causar irritación. | |
| Ojos | Puede causar irritación. | |
| Más información | Hazardous Chemical Database (en inglés) | |
| Compuestos relacionados | ||
| Haluros | CF4, CBr4, CI4 | |
| Cloruros | SiCl4, GeCl4 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El cloruro de carbono(IV) o tetracloruro de carbono, con la fórmula química CCl4, es un compuesto químico creado por el ser humano. Es un líquido sin color y con un olor un poco dulce.
Hace tiempo, se usaba mucho en la industria. Sin embargo, hoy en día ya no se utiliza debido a que es dañino para la salud y para el medio ambiente.
Cloruro de Carbono(IV): Un Compuesto Químico Importante
¿Qué es el Cloruro de Carbono(IV)?
El cloruro de carbono(IV) es una sustancia que no se quema fácilmente. Está hecho de un átomo de carbono y cuatro átomos de cloro. Por eso su fórmula es CCl4.
¿Para qué se Usaba Antes?
Este compuesto tuvo muchos usos en el pasado. Se utilizaba como extintor para apagar fuegos. También se empleaba para fabricar refrigerantes, que son sustancias que ayudan a enfriar.
Además, era un buen producto para limpiar grasas y aceites. Por eso, se usaba en la industria para extraer aceite de algunas plantas. También se usó como plaguicida (para controlar plagas) y fungicida (para eliminar hongos).
Incluso se encontraba en algunas pinturas y como desinfectante.
¿Por qué ya No se Usa?
El tetracloruro de carbono dejó de usarse por dos razones principales:
- Es una sustancia tóxica, lo que significa que puede ser muy dañina para los seres vivos.
- Cuando se descompone, forma otras sustancias que pueden dañar la capa de ozono de la Tierra. La capa de ozono nos protege de los rayos dañinos del sol.
Efectos en el Cuerpo Humano
Si una persona entra en contacto con el cloruro de carbono(IV), puede sufrir varios problemas de salud.
- Por ingestión o inhalación: Es muy peligroso. A corto plazo, puede causar dolor de cabeza, mareos, somnolencia, náuseas y vómitos. A largo plazo, puede afectar el cerebro y otros órganos importantes como el hígado y los riñones.
- En la piel y los ojos: Puede causar irritación.
El hígado es el órgano más afectado por esta sustancia. También puede causar problemas graves en los riñones, que son los encargados de filtrar la sangre.
¿Cómo Afecta al Medio Ambiente?
El cloruro de carbono(IV) puede encontrarse en pequeñas cantidades en el aire, el agua y el suelo. Cuando se libera al ambiente, puede llegar a la atmósfera y contribuir al adelgazamiento de la capa de ozono.
¿Dónde se Puede Encontrar?
Hoy en día, las cantidades de CCl4 en el aire, el agua y el suelo son muy bajas. Sin embargo, en el pasado, las personas que trabajaban en industrias que lo usaban podían estar expuestas a niveles más altos.
¿Cómo se Fabrica?
El tetracloruro de carbono se puede obtener en laboratorios. Una forma de hacerlo es mezclando dicloro (Cl2) con sulfuro de carbono (CS2). Para que la reacción ocurra, se necesita la presencia de otra sustancia llamada pentasulfuro de antimonio. Después, se separa el tetracloruro de carbono de otras sustancias que se forman.
Interacciones con Otras Sustancias
El riesgo de que el cloruro de carbono(IV) cause daño al hígado aumenta si se combina con otras sustancias. Por ejemplo, el consumo de alcohol o ciertos medicamentos como los barbitúricos pueden hacer que sus efectos tóxicos sean aún más fuertes.
Galería de imágenes
Véase también
 En inglés: Carbon tetrachloride Facts for Kids
En inglés: Carbon tetrachloride Facts for Kids