Diisopropilamida de litio para niños
Datos para niños
Diisopropilamiduro de litio |
||
|---|---|---|
| Nombre IUPAC | ||
| Diisopropilamiduro de litio | ||
| General | ||
| Otros nombres | LDA | |
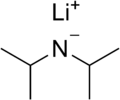
| Fórmula semidesarrollada | LiN(C3H7)2 | |
| Fórmula estructural | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 4111-54-0 | |
| ChemSpider | 21169872 2006804, 21169872 | |
| PubChem | 2724682 | |
| UNII | OL028KIW1I | |
|
InChI
InChI=InChI=1S/C6H14N.Li/c1-5(2)7-6(3)4;/h5-6H,1-4H3;/q-1;+1
Key: ZCSHNCUQKCANBX-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Densidad | 790 kg/m³; 0,79 g/cm³ | |
| Masa molar | 107,1233 g/mol | |
| Propiedades químicas | ||
| Acidez | 36 (THF) pKa | |
| Solubilidad en agua | Reacciona con el agua | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El diisopropilamiduro de litio es un compuesto químico con la fórmula [(CH3)2CH]2NLi. Se le conoce comúnmente como LDA. Es una base muy fuerte que se usa en química orgánica. Su principal función es quitar un protón (un átomo de hidrógeno con carga positiva) de otros compuestos que son un poco ácidos.
El LDA es muy útil porque se disuelve bien en líquidos orgánicos que no son polares. Además, no se enciende espontáneamente al contacto con el aire. El LDA es una base que no tiende a formar nuevos enlaces con otras moléculas, lo que la hace especial para ciertas reacciones. Existe un compuesto similar llamado diisopropilamina de potasio (KDA), que usa potasio en lugar de litio. El LDA es más económico y se usa más a menudo, aunque el KDA puede ser más potente en algunos casos.
Contenido
¿Cómo se prepara el LDA y cuál es su estructura?
El LDA se prepara mezclando una solución de diisopropilamina en un líquido llamado tetrahidrofurano (THF). Esta mezcla se enfría a temperaturas muy bajas, entre 0 y -78 grados Celsius. Luego, se le añade otro compuesto llamado n-butillitio.
La diisopropilamina es un ácido muy débil. Esto significa que el LDA es una base lo suficientemente fuerte como para quitar protones de la mayoría de los ácidos de carbono. Estos incluyen alcoholes y compuestos con grupos carbonilo (como ácidos, ésteres, aldehídos y cetonas) que tienen un átomo de hidrógeno especial. En una solución de THF, el LDA suele existir en grupos de dos moléculas (dímeros). Se cree que estos dímeros se separan para que la base pueda actuar.
El LDA se puede comprar ya preparado en soluciones con líquidos como el THF o el éter. Sin embargo, para experimentos pequeños (menos de 50 milimoles), es común y más efectivo prepararlo en el momento en el laboratorio.
Bases cinéticas y termodinámicas: ¿Cuál es la diferencia?
Cuando se quita un protón de un ácido de carbono, la reacción puede seguir dos caminos: uno controlado por la velocidad (cinético) o uno controlado por la estabilidad final (termodinámico).
¿Qué es la deprotonación controlada cinéticamente?
Para la deprotonación controlada cinéticamente, se necesita una base que sea "grande" o "voluminosa". Esto significa que la base tiene dificultad para acercarse a todos los lugares posibles para quitar un protón. Por ejemplo, en el caso de la fenilacetona, se pueden formar dos tipos diferentes de enolatos (moléculas con un enlace especial). El LDA tiende a quitar el protón del grupo metilo, lo que es el camino cinético. Esto ocurre porque el LDA es una base grande y prefiere quitar el protón más accesible rápidamente.
¿Qué es la deprotonación controlada termodinámicamente?
Una base menos fuerte, como un alcóxido, puede quitar y volver a poner el protón. Esto lleva a la formación del enolato más estable, que es el camino termodinámico. Otra forma de lograr esto es usar una base fuerte en una cantidad muy pequeña en comparación con el compuesto al que se le va a quitar el protón. Por ejemplo, con hidruro de sodio en THF, la base solo reacciona en la superficie entre el sólido y la solución. Un compuesto puede perder un protón en el lugar cinético, pero luego puede intercambiar protones con otra molécula para formar el enolato más estable.
Sin embargo, el LDA también puede actuar de otras maneras bajo ciertas condiciones. Por ejemplo, puede reaccionar con hexacarboniltungsteno en la creación de un diisopropilaminocarbino. Si las condiciones son las adecuadas, el LDA puede participar en reacciones de unión de moléculas. Existen otras amidas (compuestos similares al LDA) que son aún más voluminosas, como las que se forman al quitar un protón del hexametildisilazano.
Galería de imágenes
Véase también
 En inglés: Lithium diisopropylamide Facts for Kids
En inglés: Lithium diisopropylamide Facts for Kids