Óxido de plata para niños
Datos para niños
Óxido de plata |
||
|---|---|---|
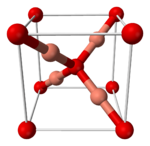 Modelo de bolas y palos del óxido de plata.
|
||
 Apariencia del óxido de plata.
|
||
| General | ||
| Fórmula semidesarrollada | Ag2O | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 20667-12-3 | |
| ChemSpider | 7970393 | |
| UNII | 897WUN6G6T | |
|
InChI
InChI=InChI=1S/2Ag.O/q2*+1;-2
Key: NDVLTYZPCACLMA-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Cristales cúbicos negros o cafés oscuros | |
| Densidad | 7140 kg/m³; 7,14 g/cm³ | |
| Masa molar | 231,735 g/mol | |
| Punto de fusión | 550 K (277 °C) | |
| Estructura cristalina | cúbico | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.000025 g/ml | |
| Solubilidad | Soluble en ácido y álcali. Insoluble en alcohol y etanol. |
|
| Producto de solubilidad | 1.52 × 10-8 (20 °C) | |
| Termoquímica | ||
| ΔfH0sólido | -31.1 kJ/mol | |
| Capacidad calorífica (C) | 65.9 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El óxido de plata (I) es un compuesto químico con la fórmula Ag2O. Se presenta como un polvo fino de color negro o café oscuro. Este compuesto se utiliza para crear otras sustancias que contienen plata.
Contenido
¿Cómo se obtiene el óxido de plata?

El óxido de plata se puede comprar en tiendas especializadas. También es posible prepararlo de forma sencilla en un laboratorio. Para ello, se mezclan soluciones acuosas de nitrato de plata y un hidróxido alcalino.
Es importante saber que, al hacer esta mezcla, no se forma mucho hidróxido de plata. Esto se debe a que el hidróxido de plata se transforma rápidamente en óxido de plata y agua.
Estructura y características del óxido de plata
El óxido de plata (Ag2O) es un polímero tridimensional. Esto significa que sus átomos se unen formando una red grande y repetitiva. En esta red, los átomos de plata y oxígeno están unidos por enlace covalentes.
Su estructura es muy parecida a la del óxido de cobre (Cu2O). Por esta razón, se espera que el óxido de plata no se disuelva en la mayoría de los líquidos, a menos que reaccione con ellos. Sin embargo, sí se disuelve un poco en agua, formando iones especiales. También se disuelve en una solución de hidróxido de amonio.
Reacciones del óxido de plata
Cuando el óxido de plata entra en contacto con ácidos, reacciona de inmediato. Por ejemplo, si se mezcla con un ácido, se forma una sal de plata y agua:
- Ag2O + 2 HX → 2 AgX + H2O
Aquí, HX puede ser HF, HCl, HBr, HI o HO2CCF3.
El óxido de plata también reacciona con soluciones de cloruros alcalinos. En esta reacción, se forma cloruro de plata sólido y una solución del hidróxido alcalino correspondiente.
Sensibilidad a la luz y al calor
El óxido de plata es sensible a la luz. Esto significa que la luz puede afectarlo y cambiarlo. Además, se descompone, es decir, se rompe en otras sustancias, si se calienta a temperaturas superiores a los 280 grados Celsius.
Usos del óxido de plata
El óxido de plata tiene varias aplicaciones importantes:
- Baterías: Se utiliza en las baterías de óxido de plata. Estas baterías son conocidas por ser pequeñas y duraderas, ideales para relojes o calculadoras.
- Química orgánica: En el campo de la química orgánica, el óxido de plata se usa como un agente oxidante suave. Esto significa que ayuda a otras sustancias a perder electrones. Por ejemplo, puede transformar aldehídos en ácido carboxílicos. A menudo, estas reacciones funcionan mejor si el óxido de plata se prepara justo en el momento de usarlo, a partir de nitrato de plata y un hidróxido alcalino.
Véase también
 En inglés: Silver oxide Facts for Kids
En inglés: Silver oxide Facts for Kids

