Epóxido para niños
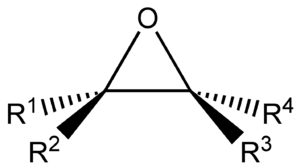
Los epóxidos son un tipo especial de compuestos orgánicos. Imagina un anillo formado por un átomo de oxígeno unido a dos átomos de carbono. Estos dos carbonos también están unidos entre sí. Esta estructura es como un pequeño triángulo muy apretado.
Debido a lo apretada que es su estructura, los epóxidos son muy reactivos. Esto significa que reaccionan fácilmente con otras sustancias. Por eso, son muy útiles en la fabricación de muchos productos. Se usan para crear polímeros, medicinas y otros productos químicos importantes.
Dos epóxidos muy conocidos son el óxido de propileno y el óxido de etileno. Ambos tienen muchas aplicaciones en la síntesis orgánica, que es el proceso de crear nuevas moléculas. Los epóxidos suelen ser líquidos sin color. También se pueden disolver en alcohol, éter y benceno.
Contenido
¿Cómo se nombran los epóxidos?
Los epóxidos tienen diferentes formas de ser nombrados.
Nombres sencillos
Los epóxidos más simples se nombran a partir de una molécula base llamada óxido de etileno, también conocida como oxirano. Un ejemplo es el clorometiloxirano. A veces, simplemente se les llama "óxido de", como el óxido de ciclohexeno. Algunos tienen nombres comunes o "triviales", como el glicidol.
Nombres más largos
Para epóxidos con cadenas de carbono más largas, se usa el prefijo «epoxi-». Se indica con números qué átomos de carbono están unidos al oxígeno. Por ejemplo, el 2,3-epoxihexano significa que el oxígeno está unido a los carbonos 2 y 3 de una cadena de seis carbonos. También se pueden nombrar como "óxido de" seguido del nombre del hidrocarburo, como 1,2-epoxiheptano, que también se puede llamar óxido de 1,2-hepteno.
¿Cómo se fabrican los epóxidos?
Existen varias maneras de crear epóxidos en el laboratorio o en la industria.
Oxidación de alquenos
La forma más común de hacer epóxidos es a partir de los alquenos. Los alquenos son moléculas que tienen un "doble enlace" entre dos carbonos. Es relativamente fácil que el oxígeno se una a este doble enlace.
Se usan sustancias llamadas peróxidos orgánicos o peroxiácidos para esta reacción. Estos agentes oxidantes rompen el doble enlace del alqueno. Así, se forma el anillo de epóxido. Esta reacción ocurre en un solo paso y no necesita catalizadores. Los peroxiácidos más usados son el ácido peroxibenzoico y el peroxiacético.
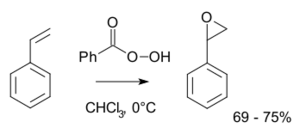
Un ejemplo es la reacción de Prileschajew. En ella, el estireno se convierte en óxido de estireno usando ácido peroxibenzoico.
Los alquenos que tienen más grupos unidos a sus carbonos reaccionan más rápido. Esta reacción es "estereoespecífica", lo que significa que prefiere formar un tipo específico de epóxido.
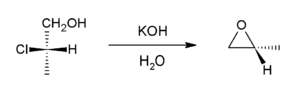
A partir de halohidrinas
Otra forma de hacer epóxidos es a través de las halohidrinas. Este proceso tiene dos pasos:
- Primero, un alqueno reacciona con un ácido hipocloroso o ácido hipobromoso. Esto forma una halohidrina, donde un halógeno y un grupo hidroxilo se unen a los carbonos del doble enlace.
- Segundo, la halohidrina se trata con una base. Esto provoca una reacción que cierra el anillo y forma el epóxido.
Este método es más económico y se usa mucho en la industria. Por ejemplo, así se produce el óxido de propileno a partir del propileno.
Usos industriales importantes
El óxido de propileno es muy importante para fabricar poliuretano. Primero, el epóxido se transforma en un poliol. Luego, este poliol reacciona con otras sustancias para formar el poliuretano. También se usa para hacer polipropilenglicol.
El óxido de etileno (oxirano) también es clave en la industria. Se usa para crear etilenglicol, que es un anticongelante y se utiliza en la producción de poliéster y el tereftalato de polietileno. El gas de óxido de etileno también se usa en hospitales para esterilizar instrumentos quirúrgicos.
Para producir óxido de etileno a gran escala, se hace reaccionar oxígeno con propileno a altas temperaturas y presiones. Se usa un catalizador de plata para ayudar a la reacción.
<chem>7H2C=CH2 + 6 O2 -> 6C2H4O + 2CO2 + 2H2O</chem>
Solo el etileno produce un epóxido cuando se quema de forma incompleta. Otros alquenos no reaccionan tan bien de esta manera.
¿Cómo reaccionan los epóxidos?
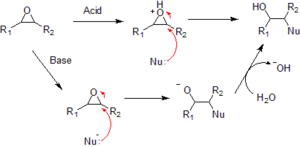
Los epóxidos son mucho más reactivos que otros tipos de éteres. Esto se debe a la tensión en su anillo. Reaccionan fácilmente con ácidos y con muchas bases. La mayoría de sus reacciones implican la "apertura" de este anillo.
Reacción con nucleófilos
Los epóxidos reaccionan con muchas sustancias llamadas nucleófilos. Los nucleófilos son moléculas que buscan unirse a un átomo con carga positiva. Ejemplos de nucleófilos son el agua, los alcoholes, las aminas y los haluros.
Cuando un nucleófilo ataca un epóxido, el anillo se abre. Si el epóxido no es simétrico, el nucleófilo suele atacar el carbono que tiene menos grupos unidos. Esto es porque es más fácil para el nucleófilo acercarse a ese carbono. Estas reacciones son la base de los adhesivos epóxicos y la producción de glicoles.
Cuando los epóxidos reaccionan con agua en un ambiente ácido, forman glicoles. Los glicoles son dioles, lo que significa que tienen dos grupos -OH (hidroxilo) en carbonos vecinos. Si la reacción se hace con un alcohol en lugar de agua, el producto final tendrá una función éter.
También se pueden reducir los epóxidos usando sustancias como el hidruro de litio y aluminio. Esto produce el alcohol correspondiente.
Véase también
 En inglés: Epoxide Facts for Kids
En inglés: Epoxide Facts for Kids