Reducción-oxidación para niños

Una reacción de reducción-oxidación, también conocida como reacción rédox, es un tipo de reacción química donde los electrones se mueven de un elemento a otro. Este movimiento de electrones hace que los elementos cambien su "estado de oxidación", que es como una puntuación que nos dice cuántos electrones ha ganado o perdido un átomo.
Para que una reacción rédox ocurra, siempre debe haber un elemento que dé electrones y otro que los reciba:
- El agente oxidante es el elemento que gana electrones. Cuando un elemento gana electrones, su estado de oxidación disminuye, y decimos que ha sido reducido.
- El agente reductor es el elemento que pierde electrones. Cuando un elemento pierde electrones, su estado de oxidación aumenta, y decimos que ha sido oxidado.
Cuando un elemento reductor cede electrones, se convierte en un elemento oxidado. De manera similar, cuando un elemento oxidante gana electrones, se convierte en un elemento reducido. Estas parejas de elementos (uno oxidado y otro reducido) se llaman "pares rédox".
Contenido
¿Cómo funcionan las reacciones rédox?
Dentro de una reacción rédox completa, ocurren dos partes más pequeñas llamadas "semirreacciones":
- Una semirreacción es de reducción, donde un elemento gana electrones. Por ejemplo:
<chem> 2 e^- + Cu^2+ -> Cu</chem>
- La otra semirreacción es de oxidación, donde un elemento pierde electrones. Por ejemplo:
<chem> Fe -> Fe^2+ + 2 e^- </chem>
Cuando sumamos estas dos semirreacciones, obtenemos la reacción rédox completa: <chem>Fe + Cu^2+ -> Fe^2+ + Cu </chem>
La capacidad de un elemento para oxidar o reducir a otros se mide con algo llamado "potencial de reducción".
¿Qué es la oxidación?

La oxidación es una reacción química donde un elemento pierde electrones. Esto hace que su "estado de oxidación" (su puntuación de electrones) aumente. Es importante saber que la oxidación no siempre significa que el oxígeno esté involucrado, aunque el nombre venga de ahí. Lo que realmente importa es el cambio en el estado de oxidación.
Las reacciones de oxidación y reducción siempre ocurren juntas. Si una sustancia se oxida (pierde electrones), es porque otra sustancia se está reduciendo (ganando esos electrones). Por eso, se usa el término general de reacciones rédox.
El oxígeno es un oxidante muy común. Un ejemplo sencillo de oxidación es cuando el hierro se oxida y forma óxido, lo que conocemos como óxido de hierro:
- Óxido de hierro (II): FeO.
- Óxido de hierro (III): Fe
2O
3.
Otro ejemplo sin oxígeno es cuando el yoduro de sodio se oxida a yodo, mientras el cloro se reduce a cloruro de sodio: <chem display="block">2 NaI + Cl2 -> I2 + 2 NaCl</chem> Esto se puede dividir en:
- Semirreacción de reducción:
- <chem> Cl_2 + 2 e^- -> 2 Cl^- </chem>
- Semirreacción de oxidación:
- <chem> 2 I^- -> I_2 + 2 e^- </chem>
¿Qué es la reducción?
En química, la reducción es el proceso por el cual un átomo o un ion gana electrones. Esto significa que su "estado de oxidación" disminuye. Es lo contrario de la oxidación.
Cuando un elemento se reduce:
- Actúa como agente oxidante (ayuda a que otra cosa se oxide).
- Es reducido por un agente reductor (otra cosa le da electrones).
- Su estado de oxidación disminuye.
Por ejemplo, un ion de hierro con carga +3 puede reducirse a un ion de hierro con carga +2 al ganar un electrón: <chem display="block"> Fe^3+ + 1e^- -> Fe^2+</chem>
El número de oxidación
El "número de oxidación" es un valor que nos ayuda a entender cuántos electrones un átomo ha ganado, perdido o compartido en un enlace químico.
- Si un átomo pierde electrones (se oxida), su número de oxidación aumenta.
- Si un átomo gana electrones (se reduce), su número de oxidación disminuye.
Algunas reglas para asignar el número de oxidación son:
- Los elementos sin combinar (solos) tienen un número de oxidación de cero.
- El hidrógeno casi siempre tiene +1, excepto en algunos compuestos con metales donde es -1.
- El oxígeno casi siempre tiene -2, excepto en los peróxidos donde es -1.
- Los metales en compuestos siempre tienen un número de oxidación positivo.
- La suma de los números de oxidación de todos los átomos en una molécula neutra es cero.
- En un ion, la suma de los números de oxidación es igual a la carga del ion.
Balanceo de reacciones rédox
Para que una ecuación química sea correcta, debe estar "balanceada". Esto significa que la cantidad de átomos de cada elemento y la carga total deben ser iguales en ambos lados de la reacción. En las reacciones rédox, esto es un poco más complejo porque también hay que balancear los electrones que se transfieren.
Para balancear reacciones rédox en agua, a menudo se añaden iones de hidrógeno (H+
), iones hidroxilo (OH−
) y moléculas de agua (H
2O) para asegurar que todo esté equilibrado.
Usos importantes de las reacciones rédox
Las reacciones rédox son muy importantes en nuestra vida diaria y en la industria:
- Producción de metales: Se usan para obtener metales como el aluminio y el hierro a partir de sus minerales.
- Prevención de la corrosión: Ayudan a proteger los metales de la corrosión (el óxido).
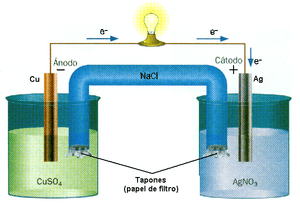
- Generación de energía: Las pilas electroquímicas (como las baterías) funcionan gracias a reacciones rédox que producen energía eléctrica.
- Electrólisis: Es el proceso inverso, donde se usa energía eléctrica para separar elementos de sus compuestos.
Reacciones rédox en los seres vivos
En los seres vivos, las reacciones rédox son fundamentales para el metabolismo, que es el conjunto de procesos químicos que mantienen la vida. Son clave en:
- La fotosíntesis: Las plantas usan la energía del sol para convertir dióxido de carbono y agua en azúcares, en un proceso que implica muchas reacciones rédox.
- La respiración aeróbica: Los animales y las plantas usan el oxígeno para "quemar" los azúcares y obtener energía, también a través de una serie de reacciones rédox.
En estos procesos, hay "cadenas transportadoras de electrones" donde los electrones se mueven de una molécula a otra, liberando energía que el cuerpo usa para producir ATP, que es como la "moneda de energía" de las células.
La combustión
La combustión es una reacción rédox muy rápida que libera mucha energía en forma de calor y luz, lo que vemos como fuego. En una combustión, siempre hay:
- Un combustible: el material que se quema (por ejemplo, madera, gas).
- Un comburente: el elemento que permite la combustión, que casi siempre es el oxígeno del aire.
Los productos de una combustión completa suelen ser dióxido de carbono (CO
2) y agua.
Consecuencias de las reacciones rédox
Una consecuencia importante de la oxidación en los metales es la corrosión, que puede dañar estructuras y objetos. Sin embargo, las reacciones rédox también se usan de forma positiva, por ejemplo, en las pilas electroquímicas para generar electricidad.
Véase también
 En inglés: Redox Facts for Kids
En inglés: Redox Facts for Kids