Coloide para niños
Un coloide es una mezcla especial donde pequeñas partículas de una sustancia están dispersas de manera uniforme en otra sustancia. Imagina que tienes una bebida de chocolate: el chocolate en polvo se mezcla tan bien con la leche que no se asienta al fondo y no puedes ver las partículas individuales. Eso es un poco como un coloide.
En física y química, un coloide, también llamado sistema coloidal o dispersión coloidal, está formado por dos partes: una sustancia que está dispersa en forma de partículas muy pequeñas (la fase dispersa) y otra sustancia en la que estas partículas se encuentran (la fase continua). La fase continua suele ser un líquido o un gas, y las partículas dispersas son generalmente sólidas.
Las partículas en un coloide son tan diminutas que no se pueden ver a simple vista. Son más grandes que las moléculas en una disolución (como el azúcar disuelto en agua), pero más pequeñas que las partículas en una suspensión (como la arena en agua, que se asienta). El tamaño de las partículas coloidales está entre 1 nanómetro (nm) y 1 micrómetro (µm).
La palabra "coloide" viene del griego "kolas", que significa "que puede pegarse". Esto se refiere a que los coloides a veces tienden a unirse o formar grumos. A diferencia de las suspensiones, los coloides no se separan al dejarlos en reposo y no se pueden filtrar fácilmente.
Las partículas coloidales tienen propiedades intermedias entre las disoluciones y las suspensiones. Están dispersas sin unirse a las moléculas del líquido y no se asientan. Algunas partículas coloidales son moléculas muy grandes, como las proteínas. Los coloides también pueden tener una cierta viscosidad, que es la resistencia que un líquido o gas presenta al movimiento de sus moléculas.
Contenido
Tipos de coloides: ¿Cómo se clasifican?
Los coloides se clasifican según qué tan fuerte es la atracción entre las partículas dispersas y el medio en el que están. Si el medio es líquido, se les llama "soles".
- Liófobos: Las partículas dispersas y el medio no se atraen mucho. Son menos estables.
- Liófilos: Las partículas dispersas y el medio se atraen mucho. Son más estables.
Si el medio es agua, se les llama "hidrófobos" (si repelen el agua) o "hidrófilos" (si atraen el agua).
Aquí tienes una tabla con ejemplos de coloides según el estado de sus fases:
| Fase dispersa | ||||
|---|---|---|---|---|
| Gas | Líquido | Sólido | ||
| Fase continua | Gas | No es posible porque todos los gases se mezclan entre sí. | Aerosol líquido, Ejemplos: niebla, bruma |
Aerosol sólido, Ejemplos: humo, polvo en suspensión |
| Líquido | Espuma, Ejemplos: espuma de afeitar, nata |
Emulsión, |
Sol, Ejemplos: pinturas, tinta china |
|
| Sólido | Espuma sólida, Ejemplos: piedra pómez, aerogeles, merengue. |
Gel, |
Sol sólido, Ejemplos: cristal de rubí |
|
Los coloides son muy importantes en la industria y la medicina. Se estudian sus propiedades ópticas (cómo interactúan con la luz), acústicas (cómo interactúan con el sonido) y su estabilidad.
¿Cómo se preparan los coloides?
Hay dos maneras principales de hacer coloides:
- Dispersión: Se toman partículas o gotas grandes y se rompen en pedazos más pequeños hasta que alcanzan el tamaño coloidal. Esto se puede hacer moliendo, pulverizando o agitando con mucha fuerza.
- Condensación: Se toman moléculas muy pequeñas disueltas y se unen para formar partículas coloidales más grandes. Esto puede ocurrir por precipitación o reacciones químicas.
Estabilidad de los coloides
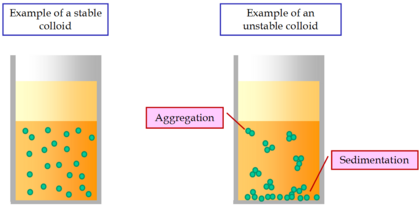
Un coloide es estable si sus partículas permanecen suspendidas y no se agrupan. Esto depende de las fuerzas que actúan entre las partículas. Si las fuerzas de atracción son muy fuertes, las partículas pueden empezar a unirse, un proceso llamado agregación, floculación o coagulación. Cuando esto sucede, el coloide se vuelve inestable y las partículas pueden asentarse o subir a la superficie.
Para que un coloide sea estable, las partículas deben repelerse entre sí o atraerse muy débilmente. Hay dos formas principales de estabilizar un coloide:
- Estabilización electrostática: Se basa en que las partículas coloidales tienen cargas eléctricas similares y se repelen entre sí.
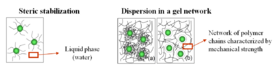
- Estabilización estérica: Se cubre la superficie de las partículas con una capa de polímero o tensioactivo. Esta capa evita que las partículas se acerquen demasiado y se peguen.
También se pueden crear coloides estables añadiendo un polímero que forme una red de gel. Esta red atrapa las partículas y evita que se asienten.
¿Cómo se desestabilizan los coloides?
Los coloides se pueden desestabilizar de varias maneras:
- Eliminando la barrera electrostática: Añadiendo sal o cambiando el pH, se puede neutralizar la carga de las partículas, haciendo que se atraigan y se agrupen.
- Añadiendo floculantes poliméricos: Son polímeros cargados que pueden unir las partículas coloidales.
- Añadiendo polímeros no adsorbidos: Estos polímeros causan que las partículas se agrupen debido a efectos de entropía.
Cuando un coloide inestable se agrupa, las partículas pueden asentarse (si son más densas) o subir (si son menos densas). Algunos coloides con muchas partículas forman geles coloidales, que son como líquidos cuando se les aplica fuerza, pero mantienen su forma cuando la fuerza se quita (como la pasta de dientes).
¿Cómo se controla la estabilidad de los coloides?
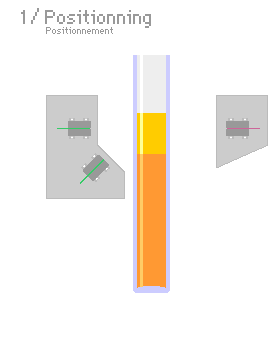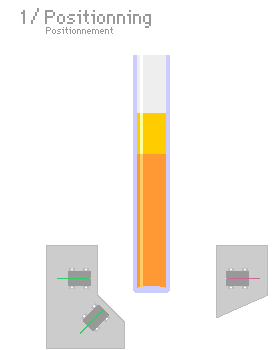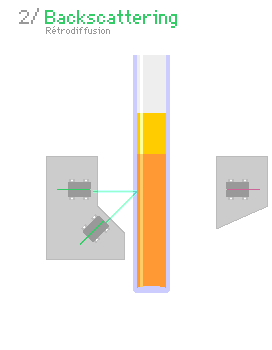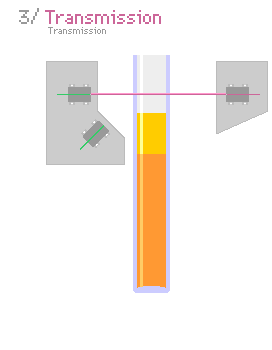
Una forma común de saber si un coloide es estable es usando la técnica de dispersión de luz múltiple. Se mide cuánta luz es dispersada por las partículas coloidales. Si la luz dispersada cambia, significa que las partículas se están agrupando o asentando.
Otra técnica es la dispersión de luz dinámica. Se usa un láser para ver cómo se mueven las partículas coloidales. Si las partículas se agrupan, se mueven más lento, lo que indica inestabilidad.
Aceleración para predecir la vida útil
A veces, los coloides tardan mucho en desestabilizarse (meses o años). Para acelerar este proceso y probar nuevos productos, se usan métodos como aumentar la temperatura. El calor puede acelerar la desestabilización hasta 200 veces. También se usan la centrifugación y la agitación, que empujan las partículas entre sí.
Sistemas coloidales y sus características
- Emulsiones: Son coloides donde tanto la fase dispersa como la continua son líquidos que no se mezclan, como la leche o la salsa mayonesa.
- Soles: Son coloides donde partículas sólidas están dispersas en un líquido. Los soles liófobos son menos estables y pueden coagularse fácilmente.
- Aerosoles: Son sistemas coloidales con partículas líquidas o sólidas muy finas dispersas en un gas. Ejemplos son la niebla o el humo.
- Gel: Se forman cuando un sol se vuelve más espeso y forma una estructura semisólida, como la gelatina o las gominolas.
- Espuma: La fase dispersante puede ser líquida o sólida y la fase dispersa es un gas. Un ejemplo es la espuma de afeitar.
Propiedades de los coloides
Adsorción
Las partículas coloidales tienen una superficie muy grande en comparación con su masa. Esto las hace excelentes para la adsorción, que es la capacidad de atraer y retener átomos, iones o moléculas de otras sustancias en su superficie. Es como si tuvieran "manos" en su superficie para agarrar otras cosas.
Efecto Tyndall
Cuando un rayo de luz atraviesa un coloide, se hace visible. Esto se debe a que las partículas coloidales dispersan la luz en todas direcciones. Puedes ver este efecto cuando un rayo de sol entra por una ventana y ves las partículas de polvo flotando en el aire.
Movimiento Browniano
Las partículas coloidales se mueven de forma desordenada y al azar. Este movimiento es causado por los choques constantes con las moléculas del medio en el que están dispersas. El movimiento browniano ayuda a que las partículas coloidales no se asienten y permanezcan dispersas. Fue observado por primera vez por el botánico Robert Brown en 1827.
Electroforesis
Es el movimiento de partículas coloidales cargadas dentro de un campo eléctrico. Las partículas coloidales pueden absorber iones en su superficie, adquiriendo una carga positiva o negativa. Aunque el sistema coloide en general es neutro, estas partículas cargadas se mueven hacia los electrodos opuestos.
Diálisis
La diálisis es un proceso que permite separar moléculas pequeñas e iones de las partículas coloidales usando una membrana porosa. Las moléculas pequeñas pueden pasar a través de la membrana, pero las partículas coloidales grandes no. Esto se usa para purificar los coloides, eliminando impurezas.
Véase también
 En inglés: Colloid Facts for Kids
En inglés: Colloid Facts for Kids
- Aerosol
- Sólido en suspensión
- Suspensión (química)
- Efecto Tyndall
- Coacervado