Bicarbonato para niños
Datos para niños
Bicarbonato |
||
|---|---|---|
| General | ||
| Fórmula estructural | 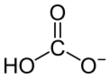 |
|
| Fórmula molecular | HCO3- | |
| Identificadores | ||
| Número CAS | 71-52-3 | |
| ChEBI | 17544 | |
| ChEMBL | CHEMBL363707 | |
| ChemSpider | 749 | |
| PubChem | 22647601 769, 22647601 | |
| UNII | HN1ZRA3Q20 | |
| KEGG | C00288 | |
|
InChI
InChI=InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4)/p-1
Key: BVKZGUZCCUSVTD-UHFFFAOYSA-M |
||
| Propiedades físicas | ||
| Masa molar | 60,993 g/mol | |
Los bicarbonatos son un tipo de sal que se forma a partir del ácido carbónico (H2CO3). Contienen una parte especial llamada anión bicarbonato (HCO3-).
Aunque el nombre "bicarbonato" es muy común, la IUPAC, que es la organización que nombra los compuestos químicos, prefiere otros nombres. Por ejemplo, se puede llamar "anión supercarbonato" o "supercarbonato del metal correspondiente" si es una sal.
El bicarbonato más conocido es el bicarbonato de sodio, también llamado supercarbonato de sodio. Su fórmula es NaHCO3. Es muy importante porque se disuelve bien en agua y se usa para fabricar carbonato de sodio mediante un proceso llamado proceso de Solvay.
Los bicarbonatos están en constante cambio con los carbonatos, el agua y el dióxido de carbono (CO2). Este equilibrio es clave en muchos procesos naturales y artificiales. Nuestro cuerpo, por ejemplo, usa sustancias especiales (llamadas catalizadores) que contienen zinc para que este cambio ocurra más rápido. Esto ayuda a que podamos respirar mejor.
El bicarbonato de calcio, cuya fórmula es Ca(CO3H)2, es más fácil de disolver en agua que el carbonato de calcio (CaCO3), que es la caliza. Esta diferencia es muy importante en la geoquímica y ha llevado a la formación de los impresionantes sistemas kársticos que vemos en las rocas de caliza.
Contenido
Usos del Bicarbonato
Los bicarbonatos que se disuelven en agua tienen propiedades básicas. Esto significa que pueden neutralizar los ácidos.
Bicarbonato de Sodio en la Vida Diaria
- Para el estómago: El bicarbonato de sodio es un ingrediente principal en muchos medicamentos que alivian la acidez estomacal. Actúa como un antiácido.
- En extintores: Este mismo compuesto se usa en los extintores de polvo para apagar fuegos.
- Para limpiar: También es un buen aliado en la limpieza del hogar, a menudo combinado con vinagre.
- En la cocina: Si calientas bicarbonato en un horno a 240°C o en una olla que no sea de aluminio, se transforma en carbonato sódico, que se usa para lavar.
Bicarbonato y la Liberación de Dióxido de Carbono
- En la repostería: Cuando los bicarbonatos entran en contacto con ácidos, liberan dióxido de carbono. Por eso se usan en las levaduras químicas para hacer que los pasteles y panes suban. A menudo se combinan con otros ingredientes como el ácido cítrico.
- En medicamentos efervescentes: También se encuentran en las tabletas o polvos efervescentes, que burbujean al disolverse en agua.
Bicarbonato en el Cuerpo
- Transporte de dióxido de carbono: Una de las funciones más importantes del bicarbonato en nuestro cuerpo es ayudar a transportar el dióxido de carbono que producimos al respirar.
Véase también
 En inglés: Bicarbonate Facts for Kids
En inglés: Bicarbonate Facts for Kids

