Batería (electricidad) para niños
Datos para niños Batería (electricidad) |
||
|---|---|---|
 Varias pilas y baterías: dos AA, una D, una batería de radioafición portátil, dos de 9 voltios (PP3), dos AAA, una C, una batería de cámara de video, una batería de teléfono inalámbrico.
|
||
| Tipo | Fuente de energía | |
| Principio de funcionamiento | Electroquímica, Fuerza electromotriz | |
| Primera producción | años 1800 | |
| Símbolo electrónico | ||
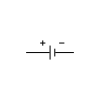 |
||
| El símbolo de una batería en un diagrama de circuito. Se originó como un dibujo esquemático del primer tipo de batería, una pila voltaica. | ||
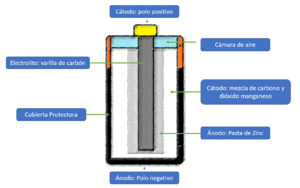
Una batería eléctrica, también conocida como acumulador eléctrico o simplemente batería, es un aparato que contiene dos o más celdas electroquímicas. Estas celdas tienen conexiones externas y transforman la energía química que guardan en corriente eléctrica.
Cuando una batería está funcionando y dando energía, su parte positiva se llama cátodo y su parte negativa se llama ánodo. El terminal negativo es el que envía los electrones a través de un circuito eléctrico hacia el terminal positivo. Dentro de la batería, una reacción química especial (llamada redox) convierte sustancias con mucha energía en otras con menos energía. La energía que se libera en este proceso se envía al circuito como electricidad. Las baterías también tienen unos electrolitos, que son sustancias que permiten que las partículas cargadas (iones) se muevan entre los electrodos.
Al principio, la palabra "batería" se usaba solo para aparatos con varias celdas. Pero con el tiempo, se empezó a usar también para aparatos con una sola celda.
Las baterías vienen en muchos tamaños y formas. Hay desde celdas muy pequeñas para audífonos y relojes de pulsera, hasta grandes grupos de baterías del tamaño de una habitación que dan energía de respaldo a centrales telefónicas y computadoras.
Contenido
¿Qué diferencia hay entre pila, batería y acumulador?
Los nombres pila y batería vienen de los primeros tiempos de la electricidad. Se usaban para describir cómo se agrupaban varios elementos (como discos de metal o celdas) para producir más corriente. Si se ponían uno encima de otro, se "apilaban", de ahí viene pila. Si se ponían uno junto a otro, se decía que estaban "en batería".
En algunos países, como España, se usan los términos batería y acumulador para las que se pueden recargar (como las de ácido-plomo). La palabra pila se usa para las que no se pueden recargar (como las alcalinas).
En otros países de habla hispana, se usa la palabra batería para todos los tipos, igual que en inglés. Allí, el término acumulador a veces se refiere a los condensadores eléctricos u otros aparatos que guardan energía.
Tipos de celdas: primarias y secundarias
Las celdas que dan electricidad se dividen en dos grupos principales:
- Las celdas primarias (o pilas no recargables) transforman la energía química en energía eléctrica de forma que no se puede revertir fácilmente. Una vez que los materiales iniciales se agotan, la energía no se puede recuperar fácilmente. Un ejemplo común es la pila alcalina que usas en linternas o juguetes.
- Las celdas secundarias (o baterías recargables) sí se pueden recargar. Esto se logra invirtiendo las reacciones químicas dentro de ellas al aplicarles energía eléctrica. Así, vuelven a su estado original. Ejemplos son las baterías de ácido-plomo de los coches, las baterías de iones de litio de los móviles y tabletas, y las baterías de níquel-metal hidruro (Ni-MH) que reemplazan a las pilas alcalinas en cámaras digitales o juguetes.
¿Cómo funcionan las baterías?
El funcionamiento de una batería se basa en un proceso químico que puede ir en dos direcciones, llamado redox. En este proceso, una sustancia pierde electrones (se oxida) y otra gana electrones (se reduce). Lo importante es que las sustancias no se gastan, solo cambian su estado químico y pueden volver a su estado original.
En las baterías recargables, esto ocurre cuando conectamos la batería a un circuito externo para que dé energía (descarga) o cuando le aplicamos una corriente para que se recargue (carga).
Los científicos del siglo XIX estudiaron mucho este fenómeno. Una batería es un aparato con dos electrodos (que pueden ser del mismo o diferente material) sumergidos en un electrolito.
Breve historia de las baterías
El 20 de marzo de 1800, Alessandro Volta presentó su invento: la pila que lleva su nombre. Años después, en 1803, Johann Wilhelm Ritter creó su propio acumulador eléctrico, aunque era más un experimento que algo práctico.
En 1836, John Frederic Daniell inventó la Pila Daniell, una mejora de la pila de Volta. Más tarde, en 1844, William Robert Grove inventó la Pila de combustible, que era más potente y se usó mucho en las redes de telégrafos en Estados Unidos.
En 1860, Gaston Planté construyó el primer modelo de batería de plomo y ácido que buscaba ser útil, pero no tuvo mucho éxito al principio. A finales del siglo XIX, la electricidad se hizo más común. Cuando Planté volvió a presentar su acumulador en 1879, fue muy bien recibido y se empezó a fabricar y usar de inmediato. Desde entonces, se ha trabajado mucho para mejorarla.
En 1887, Carl Gassner patentó la pila seca, que no usaba un líquido, sino una pasta. Ese mismo año, Federico Guillermo Luis Hellesen también desarrolló un diseño de pila seca. La primera pila seca fabricada para el público se basó en el modelo de Gassner.
A finales del siglo XIX, en 1899, el científico sueco Waldemar Jungner inventó el acumulador de níquel-cadmio (Ni-Cd), una batería recargable. Se empezó a vender en Suecia en 1910 y llegó a Estados Unidos en 1946. Thomas Alva Edison, basándose en el trabajo de Jungner, patentó en 1903 otro tipo de acumulador con hierro y níquel. Estos se empezaron a vender en 1908 y aún se producen.
A mediados del siglo XX, en 1955, el ingeniero Lewis Urry desarrolló las conocidas pilas alcalinas, que salieron al mercado en 1959.
Las baterías de litio se empezaron a investigar en 1912, pero no se vendieron comercialmente hasta la década de 1970.
Las primeras baterías de níquel metal hidruro (NiMH) para uso común aparecieron en el mercado en 1989.
En la década de 1980, el químico estadounidense John B. Goodenough lideró un equipo que creó la batería de iones de litio recargable. En 1996, se lanzó al mercado la batería de polímero de ion de litio, que es más flexible.
¿Qué características tienen las baterías?
Las baterías tienen varias características importantes que nos ayudan a saber para qué sirven:
Voltaje o tensión
El voltaje (medido en voltios) es lo primero que miramos. Nos dice si la batería es adecuada para lo que queremos usarla. Cada tipo de batería tiene un voltaje específico por celda, que suele estar entre 1 y 4 voltios.
Imagina el voltaje como la altura de una cascada de agua. Cuanto más alta sea la cascada, más fuerza tendrá el agua para mover una noria. Una batería con más voltaje puede hacer más "trabajo" eléctrico. Por ejemplo, en coches de juguete a control remoto, una batería con más voltaje dará más potencia al motor.
Intensidad de corriente
La intensidad de corriente es la cantidad de carga eléctrica que pasa por un cable en un tiempo determinado. Se mide en amperios (A).
Siguiendo la analogía de la cascada, la intensidad de corriente es como el caudal o la cantidad de agua que fluye por la cascada. Cuanto mayor sea la corriente, más fuerza tendrá un motor eléctrico.
Capacidad de carga
La capacidad de carga nos dice cuánta energía puede guardar una batería. Se mide en amperios-hora (Ah) o miliamperios-hora (mAh) para baterías más pequeñas.
Si una batería tiene una capacidad de 1 Ah, en teoría puede dar 1 amperio de corriente durante 1 hora antes de agotarse. O podría dar 0.1 amperios durante 10 horas. Una batería de 2400 mAh durará el doble que una de 1200 mAh porque guarda más energía. Puedes usar baterías con cualquier capacidad en un aparato, solo afectará cuánto tiempo funcionará.
Es importante saber que si una batería da mucha corriente, su tiempo de funcionamiento se reduce más de lo que indica su capacidad. Para saber cuánta corriente puede dar sin agotarse rápido, se usa la "tasa de descarga".
Energía
La cantidad total de energía que una batería puede dar depende de su capacidad y su voltaje. Se mide en Wh (vatios-hora) o julios.
La energía se calcula multiplicando la capacidad por el voltaje. Por ejemplo, si una batería de 12 voltios tiene una capacidad de 10 Ah, su energía es 120 Wh.
Cuando cargas una batería, si le das más energía de la que puede almacenar, el exceso se convierte en calor dentro de la batería.
Resistencia
La resistencia interna de una batería es muy baja, lo que le permite dar corrientes muy fuertes, especialmente por poco tiempo. Por ejemplo, la batería de un coche tiene una resistencia muy baja para poder arrancar el motor, que necesita mucha corriente.
Masa
El peso de una batería también es importante, especialmente la relación entre su peso y la energía que puede dar (Wh/kg). A veces, el volumen que ocupa (Ah/litro) también es relevante.
Rendimiento
El rendimiento es el porcentaje de energía que una batería devuelve durante la descarga, comparado con la energía que recibió al cargarse. Por ejemplo, una batería de plomo-ácido tiene un rendimiento de más del 90%, lo que significa que casi toda la energía que se le mete al cargarla, la devuelve al descargarse.
Tasa de carga/descarga
La "tasa C" es un valor que indica qué tan rápido se puede cargar o descargar una batería sin dañarla. Se calcula dividiendo la corriente de carga o descarga por la capacidad de la batería (en Ah).
Por ejemplo, si una batería de 55 Ah se carga o descarga con 55 A, su tasa es 1C. Si se carga o descarga con 82.5 A, la tasa es 1.5C.
Los fabricantes indican la "tasa de carga máxima" y la "tasa de descarga máxima" para que sepas los límites seguros. Así, puedes comparar el rendimiento de baterías de diferentes tamaños.
- Ejemplo
Si tienes una batería de 1200 mAh y el fabricante dice que su tasa de carga máxima es 1C, no deberías cargarla con más de 1.2 A. Si la tasa de descarga máxima es 7C, no deberías descargarla con más de 8.4 A.
Efecto memoria
El efecto memoria es un problema que afecta a algunas baterías recargables. Si las recargas sin que se hayan descargado por completo, pueden "recordar" que solo usaste una parte de su capacidad. Esto hace que, con el tiempo, su capacidad para almacenar energía se reduzca.
Tipos de baterías recargables
Aquí te presentamos algunos de los tipos de baterías recargables más comunes:
Baterías de plomo-ácido
Estas baterías tienen dos electrodos de plomo y un líquido llamado ácido sulfúrico como electrolito. Cuando la batería está descargada, el plomo se convierte en sulfato de plomo (II).
- Cómo funcionan:
* Carga: Al cargarla, el sulfato de plomo se transforma de nuevo en plomo y en óxido de plomo (IV). * Descarga: Al descargarse, el óxido de plomo y el plomo se convierten otra vez en sulfato de plomo, liberando electrones que usamos como corriente eléctrica. La concentración del ácido sulfúrico baja durante la descarga, por eso se puede saber el estado de carga midiendo la densidad del ácido.
- Ventajas: Son baratas y fáciles de fabricar.
- Desventajas: No les va bien si se sobrecargan o se descargan por completo, lo que acorta su vida. Son pesadas y pueden ser contaminantes.
- Características: Cada celda da 2 voltios. Una batería de coche suele tener 6 celdas para dar 12 voltios.
- Usos: Se usan mucho en automóviles para el arranque, en sistemas de energía solar y como respaldo para equipos importantes como los de hospitales o computadoras.
Baterías de níquel-hierro (Ni-Fe)
Inventadas por Waldemar Jungner y mejoradas por Thomas Alva Edison, estas baterías usan níquel y hierro. Su electrolito es una solución alcalina.
- Ventajas: Son económicas, fáciles de hacer y muy duraderas. Pueden soportar sobrecargas y descargas completas sin dañarse mucho. No son contaminantes y sus materiales son abundantes. Funcionan bien en un amplio rango de temperaturas.
- Desventajas: Su eficiencia es un poco menor que la de otros tipos.
- Características: Dan entre 1.2 y 1.4 voltios por celda.
Baterías de níquel-cadmio (Ni-Cd)
Estas baterías usan hidróxido de níquel y un compuesto de cadmio. Se pueden recargar, pero guardan poca energía en relación a su peso.
- Ventajas: Funcionan bien en un amplio rango de temperaturas y soportan sobrecargas.
- Desventajas: Tienen un efecto memoria muy alto y guardan poca energía.
- Características: Dan 1.2 voltios.
Baterías de níquel-hidruro metálico (Ni-MH)
Estas baterías usan hidróxido de níquel y una aleación de hidruro metálico.
- Ventajas: Se ven menos afectadas por el efecto memoria.
- Desventajas: No funcionan bien con frío extremo, lo que reduce su potencia.
- Características: Dan 1.2 voltios.
Baterías de iones de litio (Li-ion)
Las baterías de iones de litio son más modernas. Usan grafito y óxido de cobalto o manganeso. Son muy buenas para guardar mucha energía. Suelen tener un circuito especial para evitar que se carguen demasiado o se descarguen por completo, ya que esto las daña.
- Ventajas: Casi no tienen efecto memoria, así que puedes cargarlas sin que estén totalmente descargadas. Guardan mucha energía.
- Desventajas: No soportan bien los cambios de temperatura y se dañan si se descargan por completo.
- Características: Su voltaje varía entre 3.6 y 4.2 voltios, dependiendo de la carga.
- Usos: Se usan en móviles, tabletas, libros electrónicos, etc.
Baterías de polímero de litio (LiPo)
Son una variación de las baterías de iones de litio. Guardan aún más energía y pueden dar mucha corriente rápidamente. Son más pequeñas y ligeras.
- Ventajas: Guardan mucha energía en poco espacio y pueden dar mucha corriente.
- Desventajas: Se dañan si su voltaje baja de 3 voltios.
- Características: Cada celda da 3.7 voltios. Se pueden agrupar para obtener voltajes mayores (por ejemplo, 3S significa 3 celdas en serie, dando 11.1 V).
- Usos: Son muy útiles para aparatos pequeños que necesitan mucha potencia y duración, como los manos libres bluetooth.
Pilas de combustible
La pila de combustible no es una batería tradicional, pero también convierte energía química en energía eléctrica y puede "recargarse" con combustible. Funciona con hidrógeno (o con otros combustibles que producen hidrógeno).
Condensadores de alta capacidad
Los condensadores de alta capacidad no son baterías químicas, pero pueden guardar mucha energía (varios faradios). Se usan como baterías en algunos relojes de pulsera que se cargan con la luz (usando células fotovoltaicas) o con el movimiento.
¿Cómo se reciclan las baterías?

La mayoría de las baterías contienen metales pesados y sustancias químicas que pueden ser dañinas para el medio ambiente. Por eso, en muchos países no se pueden tirar a la basura común. Es obligatorio llevarlas a un centro de reciclaje. Muchas tiendas que venden baterías también las recogen cuando están gastadas. Es muy importante seguir estas reglas para proteger nuestro planeta.
Algunas baterías pueden liberar vapor de mercurio si se rompen. El mercurio es un metal que puede ser muy dañino para la salud.
- Mercurio: Algunas pilas antiguas, especialmente las de óxido de mercurio, contenían mucho mercurio. Aunque su producción se ha reducido, es importante saber que este metal puede contaminar el agua y el aire. El mercurio puede afectar el desarrollo del cerebro en niños pequeños y causar problemas de salud en adultos si se exponen a él por mucho tiempo.
- Manganeso: El óxido de manganeso es otro componente común en las pilas. Grandes cantidades de manganeso liberadas al ambiente pueden ser perjudiciales. Ha habido casos de problemas de salud relacionados con la exposición a altos niveles de manganeso en el agua.
Reciclar las baterías ayuda a evitar que estas sustancias dañinas lleguen al medio ambiente y afecten nuestra salud.
Galería de imágenes
-
Batería de ácido-plomo para automóvil.
Véase también
 En inglés: Battery Facts for Kids
En inglés: Battery Facts for Kids
- Pila eléctrica
- Batería de automóvil
- Cargador de baterías
- Estación de carga
- Vehículo híbrido eléctrico enchufable
- Pila de limón
- Supercondensador
- Vehículo eléctrico
- Vehículo híbrido