Análisis volumétrico para niños
La valoración o titulación es un método muy útil en la química que nos ayuda a descubrir la cantidad exacta de una sustancia que no conocemos, usando otra sustancia de la que sí sabemos su concentración. Como se miden volúmenes con mucha precisión, a este proceso también se le llama análisis volumétrico o volumetría.
Para que una valoración funcione bien, la reacción química entre las sustancias debe ser muy completa y rápida. Además, necesitamos una forma de saber cuándo la reacción ha terminado. Para esto, se usan los llamados indicadores, que suelen cambiar de color.
Contenido
- ¿Qué es la valoración y cómo funciona?
- La historia de la valoración
- Preparación de una muestra para valorar
- ¿Cómo se calcula el resultado de una valoración?
- Curvas de valoración
- Tipos de valoraciones
- Cómo se detecta el punto final de una valoración
- Técnicas de valoración
- Algunos usos de la valoración
- Véase también
¿Qué es la valoración y cómo funciona?
La valoración es una técnica clásica en la química. Imagina que tienes una bebida y quieres saber cuánta azúcar tiene. En la valoración, usamos una sustancia conocida (llamada "valorante" o "titulador") para que reaccione con la sustancia que queremos medir (el "analito").
El proceso de valoración paso a paso
Para hacer una valoración, se usa un instrumento llamado bureta, que es un tubo largo y delgado con marcas para medir volúmenes con mucha precisión.
- Primero, se coloca el analito (la sustancia desconocida) en un recipiente, como un matraz Erlenmeyer.
- Luego, se añade una pequeña cantidad de un indicador a la solución del analito. Este indicador es clave porque cambiará de color cuando la reacción termine.
- El valorante (la sustancia conocida) se va añadiendo poco a poco desde la bureta al matraz.
- Se sigue añadiendo el valorante hasta que el indicador cambia de color de forma permanente. Este momento se llama punto final.
- El punto de equivalencia es el momento ideal en el que las dos sustancias han reaccionado completamente. El punto final que detectamos con el indicador debería ser lo más parecido posible al punto de equivalencia. Si hay una pequeña diferencia, se le llama error en la valoración.
Por ejemplo, si valoramos un ácido con una base, el punto de equivalencia es cuando la solución se vuelve neutra (pH 7). Pero un indicador como la fenolftaleína cambia de color (de transparente a rosa) un poco después, cuando el pH es alrededor de 8.2. Esto significa que se necesita una o dos gotas más de valorante para ver el cambio de color.

¿Por qué son importantes los indicadores?
Los indicadores son muy importantes porque nos avisan visualmente cuando la reacción ha terminado. Pueden cambiar de color, hacer que aparezca o desaparezca un color, o incluso que la solución se vuelva turbia.
- La fenolftaleína, por ejemplo, es incolora en soluciones ácidas y se vuelve rosa en soluciones básicas.
- Otro indicador, el naranja de metilo, es rojo en soluciones ácidas y amarillo en soluciones básicas.
A veces, no se necesita añadir un indicador extra. Esto ocurre si una de las sustancias que reaccionan o uno de los productos ya tiene un color muy fuerte que cambia claramente. Por ejemplo, en algunas valoraciones, si se usa permanganato de potasio (que es de color rosa/violeta), la solución se vuelve incolora cuando reacciona. Cuando el color rosa vuelve a aparecer y no desaparece, sabemos que la reacción ha terminado.
La historia de la valoración
Aunque hoy en día hay muchos métodos modernos, la valoración fue una gran novedad en la química en el siglo XIX. Al principio, algunos químicos preferían otros métodos, pero la industria necesitaba formas más rápidas y sencillas de controlar la calidad de sus productos.
Los primeros pasos de la volumetría
No se sabe exactamente cuándo empezó a usarse la valoración. Algunos creen que Robert Boyle, alrededor de 1663, fue uno de los primeros en usar indicadores ácido-base, como el jarabe de violetas, para ver cambios en la acidez.
Más tarde, en 1729, Claude-Joseph Geoffroy usó carbonato de potasio para medir la acidez del vinagre, observando cuándo dejaba de burbujear. El químico escocés Francis Home, en 1756, describió un método para estimar la cantidad de potasa usando ácido nítrico. En ese tiempo, no existían instrumentos precisos como la bureta o la pipeta.
La invención de la bureta y la pipeta
En 1791, François Antoine Henri Descroizilles creó la primera bureta, que era un cilindro graduado. La llamó "Bethollimetro" y luego "alcalímetro". Años después, Joseph Louis Gay-Lussac mejoró la bureta y fue quien usó por primera vez los términos "pipeta" y "bureta" en 1824.
Un gran avance se dio gracias a Karl Friedrich Mohr, quien rediseñó la bureta con una pinza y una cánula para verter, y escribió el primer libro sobre su uso en 1855.
El desarrollo de los indicadores
Los indicadores de color, como los que usaba Boyle, se hicieron más comunes con el tiempo. En 1767, William Lewis sugirió usar jugos de vegetales para encontrar el "punto de saturación" (el punto final). A partir de 1870, con el desarrollo de nuevos colorantes sintéticos, el uso de indicadores en la valoración creció muy rápidamente.
Preparación de una muestra para valorar
Para valorar una sustancia, tanto el analito como el valorante deben estar en estado líquido o disueltos. Si la muestra es sólida, primero hay que disolverla. Si está muy concentrada, a menudo se diluye.
Aunque la mayoría de las valoraciones se hacen en agua, también se pueden usar otros líquidos como ácido acético o etanol. Es muy importante saber exactamente cuánto disolvente se usa para disolver o diluir la muestra, para poder calcular bien el resultado final.
A veces, es necesario controlar el pH de la reacción. Para esto, se añaden "soluciones amortiguadoras" que ayudan a mantener el pH estable. En otros casos, si hay varias sustancias que podrían reaccionar, se puede "enmascarar" o "bloquear" una de ellas para que solo reaccione la que nos interesa. Esto se hace añadiendo otra sustancia que se una débilmente al ion no deseado o forme un sólido con él.
Algunas reacciones necesitan calor para ser más rápidas. Por ejemplo, para valorar ciertas soluciones, hay que calentarlas a unos 60 grados Celsius.
¿Cómo se calcula el resultado de una valoración?
Una vez que se ha alcanzado el punto final y se ha medido el volumen de valorante usado, se pueden hacer cálculos para encontrar la concentración desconocida.
- Se lee el volumen exacto de valorante que se usó en la bureta.
- Como conocemos la concentración del valorante y el volumen que se añadió, podemos calcular la cantidad de sustancia (en moles) que se usó.
- Usando la ecuación química de la reacción, podemos saber cuánta sustancia desconocida (analito) había en la muestra.
- Finalmente, dividiendo la cantidad de analito por el volumen inicial de la muestra, obtenemos su concentración.
Curvas de valoración
Las valoraciones se pueden representar con gráficos llamados "curvas de valoración". En estos gráficos, el volumen de valorante añadido se pone en el eje horizontal, y un valor que cambia durante la reacción (como el pH en las valoraciones ácido-base) se pone en el eje vertical.
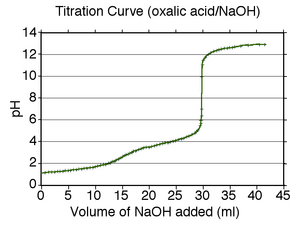
En las valoraciones ácido-base, la forma de la curva nos dice si el ácido y la base son fuertes o débiles.
- Si se valora un ácido fuerte con una base fuerte, la curva es suave, pero muy empinada cerca del punto de equivalencia. Esto significa que un pequeño cambio en el volumen del valorante causa un gran cambio en el pH. Aquí, muchos indicadores funcionan bien.
- Si uno de los componentes es débil (un ácido débil o una base débil), la curva es más irregular cerca del punto de equivalencia. En estos casos, el pH no cambia tanto con cada gota de valorante. Por ejemplo, en la valoración del ácido oxálico (un ácido débil) con hidróxido de sodio (una base fuerte), el punto de equivalencia ocurre a un pH entre 8 y 10. Para esta valoración, la fenolftaleína es un buen indicador.
- Cuando se valoran un ácido débil y una base débil, la curva es muy irregular y a menudo no hay un indicador químico adecuado. En estos casos, se usa un pH-metro para medir el pH con precisión.
Tipos de valoraciones
Las valoraciones se clasifican según el tipo de reacción química que ocurre:
Valoraciones ácido-base
Estas valoraciones se basan en la reacción de neutralización entre un ácido y una base.
- El valorante (ácido o base) se pone en la bureta.
- El analito (la sustancia que queremos medir, que es ácida o básica) se pone en el matraz.
- Se usa un indicador de pH (como los de la tabla de abajo) o un pH-metro para saber cuándo termina la reacción.
| Indicador | Color en medio ácido | Rango de cambio de color | Color en medio básico |
|---|---|---|---|
| Violeta de metilo | Amarillo | 0.0 - 1.6 | Violeta |
| Azul de bromofenol | Amarillo | 3.0 - 4.6 | Azul |
| Naranja de metilo | Rojo | 3.1 - 4.4 | Amarillo |
| Rojo de metilo | Rojo | 4.4 - 6.2 | Amarillo |
| Tornasol | Rojo | 5.0 - 8.0 | Azul |
| Azul de bromotimol | Amarillo | 6.0 - 7.6 | Azul |
| Fenolftaleína | Incolora | 8.3 - 10.0 | Rosa |
| Amarillo de alizarina | Amarillo | 10.1 - 12.0 | Rojo |
Valoraciones redox (Oxido-Reducción)
Estas valoraciones se basan en reacciones donde las sustancias intercambian electrones (reacciones de oxidación-reducción o reacción redox).
- Un agente oxidante o reductor se pone en la bureta.
- El otro agente (reductor u oxidante) se pone en el matraz.
- A menudo se usa un potenciómetro o un indicador especial para saber el punto final.
- A veces, no se necesita indicador porque una de las sustancias ya tiene un color fuerte que cambia claramente, como el permanganato de potasio que es rosa y se vuelve incoloro al reaccionar.
Valoraciones de formación de complejos o complexometrías
Estas valoraciones se basan en la formación de un "complejo" (una unión especial) entre el analito y el valorante.
- El agente quelante EDTA es muy usado para valorar iones de metales.
- Se necesitan indicadores especiales que forman complejos más débiles con el analito, como el Negro de eriocromo T para valorar iones de calcio o magnesio.
Valoraciones de precipitación
Estas valoraciones se basan en reacciones de precipitación, donde se forma un sólido insoluble.
- Se usan principalmente para medir haluros (como cloro, bromo, yodo) con soluciones de nitrato de plata (llamado argentometría).
- A veces es difícil saber el punto final porque el sólido se forma lentamente o no hay un buen indicador.
Cómo se detecta el punto final de una valoración
Hay varias formas de saber cuándo la reacción ha terminado:
- Indicadores visuales: Son sustancias que cambian de color.
* Indicador de pH: Cambia de color según el pH de la solución. * Indicador Redox: Cambia de color cuando ocurre una reacción de oxidación-reducción.
- Potenciómetro: Mide el potencial eléctrico de la solución. Se usa en valoraciones redox; el potencial cambia bruscamente en el punto final.
- Medidor de pH: Es un tipo de potenciómetro que mide el pH de la solución. El pH cambia rápidamente en el punto final. Es más preciso que los indicadores y se puede automatizar.
- Conductancia: La conductividad de una solución depende de los iones que tiene. Durante muchas valoraciones, la conductividad cambia mucho.
- Cambio de color propio: Algunas reacciones cambian de color por sí mismas, sin necesidad de un indicador extra, porque los reactivos o productos tienen colores diferentes.
- Precipitación: Si se forma un sólido durante la reacción. Por ejemplo, la reacción entre iones de plata (Ag+) y cloro (Cl-) forma cloruro de plata (AgCl), que es un sólido.
- Valoración calorimétrica: Usa el calor que se produce o se consume en la reacción para encontrar el punto final.
- Espectroscopía: Mide cómo la solución absorbe la luz. Si se conoce el color de las sustancias, se puede ver cómo cambia la absorción de luz para saber el punto final.
Técnicas de valoración
Existen diferentes maneras de realizar una valoración:
Valoración directa
Es la forma más sencilla. Se añade el valorante directamente al analito hasta que el indicador cambia de color. Es la técnica más común cuando la reacción es rápida y se tiene un buen indicador.
Valoración por retroceso
Se usa cuando la reacción es lenta o no hay un buen indicador. Se añade un exceso conocido de valorante al analito. Luego, el valorante que sobró (el exceso) se valora con otra sustancia. Así, se puede calcular cuánto valorante reaccionó con el analito.
Valoración por desplazamiento
Se usa en algunas valoraciones de complejos. Si no hay un indicador adecuado para el ion metálico que se quiere medir, se añade un complejo de EDTA con otro metal (por ejemplo, Mg(EDTA)). El ion metálico del analito desplaza al magnesio del complejo, liberando magnesio, que es más fácil de valorar.
Valoración indirecta
En este caso, no se valora el analito directamente, sino una sustancia que el analito produce en una reacción previa. Esta reacción debe ser muy conocida, y los productos o el exceso de reactivo no deben interferir en la valoración.
Algunos usos de la valoración
La valoración se usa en muchas áreas:
- Biocombustibles: Se usa para determinar la acidez de una muestra de combustible vegetal. Sabiendo cuánta base se necesita para neutralizar una pequeña cantidad, se puede calcular cuánta base se necesita para todo el lote.
- Petroquímica e industria alimentaria: Se usa para conocer las propiedades de aceites, grasas y sustancias similares.
Valoraciones aplicables a grasas y aceites
- Número ácido: Mide la cantidad de ácidos grasos libres en un biocombustible. Indica cuántos miligramos de hidróxido de potasio se necesitan para neutralizar todos los ácidos en un gramo de muestra.
- Grado de acidez: Mide el contenido de ácido graso libre en una muestra para saber su acidez.
- Número de yodo: Mide el grado de "insaturación" de una grasa (cuántos dobles enlaces tiene). Se usa para verificar la pureza de las grasas. Es la cantidad de yodo que absorben 100 gramos de grasa.
- Número de saponificación: Mide cuántos miligramos de hidróxido de potasio se necesitan para transformar un gramo de grasa en jabón. Ayuda a saber si una grasa es "saponificable" y da una idea de la longitud de sus cadenas de ácidos grasos.
- Índice de peróxidos: Mide la cantidad de peróxidos en aceites o grasas, lo que indica su nivel de oxidación.
Véase también
 En inglés: Titration Facts for Kids
En inglés: Titration Facts for Kids