Indicador de pH para niños
Un indicador de pH es una sustancia especial que nos ayuda a saber si una disolución es ácida, básica o neutra. Cambia de color según el nivel de pH de la disolución donde se encuentra. Este cambio de color ocurre porque la sustancia indicadora cambia su estructura cuando gana o pierde ciertas partículas llamadas protones.
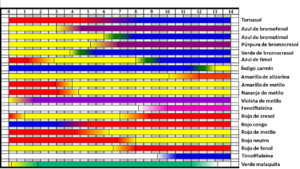
Los indicadores de pH tienen un rango de cambio de color, llamado "intervalo de viraje". En este rango, que suele ser de aproximadamente dos unidades de pH, la disolución cambia de un color a otro.
Algunos indicadores muy conocidos son el naranja de metilo, que cambia de rojo a naranja entre un pH de 3.1 y 4.4, y la fenolftaleína, que pasa de incolora a rosada o violeta entre un pH de 8 y 10.
También podemos usar indicadores caseros. Por ejemplo, el líquido que se obtiene al hervir col lombarda con agua, o los pétalos de rosa roja. La cúrcuma también se usa para obtener curcumina, que es otro indicador natural.
Contenido
¿Cómo funcionan los indicadores de pH?
Muchos compuestos químicos, tanto naturales como creados en laboratorios, tienen la capacidad de cambiar de color según el pH de las disoluciones. Por eso los llamamos indicadores de pH. Nos permiten medir el pH de una disolución de forma aproximada.
Estas sustancias son, en realidad, ácidos o bases débiles. Esto significa que se separan solo un poco en iones cuando están en agua. El color que muestran depende de cuánto se separen. La forma ácida del indicador tiene un color diferente a su forma básica.
Imagina un indicador como un ácido débil. Lo llamaremos HIn (su forma ácida) y In- (su forma básica). Su equilibrio en el agua se ve así:
<chem display="inline">HIn (color-acido) + H2O <=> In- (color-base) + H3O+</chem>
Si el indicador es una base débil, también tiene un equilibrio similar:
<chem>In (color-base) + H2O <=> InH+ (color-acido) + OH-</chem>
Estos equilibrios se pueden describir con una constante de disociación ácida, que se llama Ka. Para el indicador ácido, la fórmula es:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): K_a=\frac{[H_3O^+][In^-]}{[HIn]} \,
Si reorganizamos la fórmula, obtenemos:
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): [H_3O^+] = K_a\ \frac{[HIn]}{[In^-]}
Cuando hay mucha concentración de H3O+ (lo que significa un pH ácido), la forma ácida (HIn) será mucho mayor que la forma básica (In-). Por lo tanto, veremos el color de la forma ácida.
Si la concentración de H3O+ es muy baja (pH básico), la forma básica (In-) será mucho mayor que la forma ácida (HIn). En este caso, veremos el color de la forma básica.
Cuando las concentraciones de HIn y In- son iguales, la disolución tendrá un color intermedio. En este punto, el pH de la disolución es igual al pKa del indicador.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): pH = pK_a
Sabiendo los colores de las formas ácida y básica de un indicador, y su pKa, podemos estimar si el pH de una disolución es ácido, básico o cercano al pKa. Si usamos varios indicadores, la medición puede ser más precisa. Algunos indicadores tienen dos pKa, lo que significa que pueden tener tres colores diferentes según el pH.
¿Qué es el intervalo de viraje?
El intervalo de viraje es el rango de pH donde el indicador cambia claramente de un color a otro. Este cambio ocurre entre un valor de pH mínimo y uno máximo. Cada indicador tiene su propio intervalo de viraje, que suele ser de unas dos unidades de pH, una por debajo y otra por encima de su pKa.
Esto se debe a que el ojo humano no percibe bien los cambios de color muy sutiles. Cuando el pH está muy cerca del pKa del indicador, hay una mezcla de las formas ácida y básica. Si una forma es diez veces más abundante que la otra, el ojo ya no detecta cambios significativos.
Matemáticamente, el indicador muestra el color ácido cuando la proporción de la forma ácida es diez veces mayor que la básica. Y muestra el color básico cuando la proporción de la forma básica es diez veces mayor que la ácida. Entre estos dos puntos, el color es una mezcla.
Esto significa que el ojo humano verá el color de la forma ácida cuando el pH de la disolución sea al menos una unidad menor que el pKa del indicador.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): pH = pK_a -1
Y verá el color de la forma básica cuando el pH sea al menos una unidad mayor que el pKa.
Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): pH = pK_a + 1
Por lo tanto, el cambio de color del indicador ocurre en un intervalo de pH que es aproximadamente pKa ± 1. Este intervalo es muy importante cuando se usan indicadores para saber cuándo termina una valoración ácido-base. Es una estimación, ya que la percepción de los colores puede variar entre personas.
Tipos de indicadores de pH
Existen más de doscientas sustancias que pueden funcionar como indicadores de pH. Las más comunes en disoluciones acuosas pertenecen a los siguientes grupos:
Colorantes azoicos
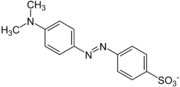
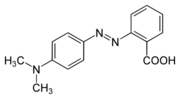
Muchos indicadores ácido-base tienen un grupo químico llamado azo (-N=N-). Son derivados del azobenceno con otros grupos que los hacen más solubles en agua. Estos indicadores son básicos. El nitrógeno del grupo azo puede unirse a un protón en un medio ácido, cambiando su estructura y color. Ejemplos de este grupo son el naranja de metilo y el rojo de metilo.
|
Ftaleínas
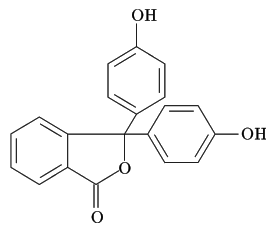
Las ftaleínas son un tipo de indicadores que no se disuelven bien en agua, pero sí en alcohol. Por eso, se preparan en disoluciones de etanol. La mayoría de las ftaleínas son incoloras en su forma ácida y se vuelven azules o violetas en su forma básica. El indicador más conocido de este tipo es la fenolftaleína, que cambia de incoloro a violeta a partir de un pH de 8.0.
Sulfoftaleínas
Las sulfoftaleínas son similares a las ftaleínas, pero tienen un grupo sulfonato (-SO3-) en su estructura. No se disuelven bien en agua en su forma ácida, pero sus sales sí son muy solubles. Se preparan en disoluciones acuosas con pH básico. A diferencia de las ftaleínas, estas tienen color tanto en su forma ácida como en su forma básica. Ejemplos de este grupo son el azul de bromotimol y el verde de bromocresol.
|
Más información
- Anexo: Indicadores de pH
- Indicador químico
- pH
- pKa