Alanina para niños
Datos para niños
Alanina |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Ácido 2-aminopropanoico | ||
| General | ||
| Símbolo químico | Ala, A | |
| Fórmula estructural | 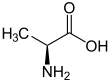 |
|
| Fórmula molecular | C3H7NO2 | |
| Identificadores | ||
| Número CAS | 56-41-7 | |
| ChEBI | 57972 16977, 57972 | |
| ChEMBL | CHEMBL279597 | |
| ChemSpider | 5735 | |
| DrugBank | DB00160 | |
| PubChem | 5950 | |
| UNII | OF5P57N2ZX | |
| KEGG | C00041 D00012, C00041 | |
|
CC(N)C(O)=O
|
||
|
InChI
InChI=InChI=1S/C3H7NO2/c1-2(4)3(5)6/h2H,4H2,1H3,(H,5,6)/t2-/m0/s1
Key: QNAYBMKLOCPYGJ-REOHCLBHSA-N |
||
| Propiedades físicas | ||
| Densidad | 1424 kg/m³; 1,424 g/cm³ | |
| Masa molar | 89,09 g/mol | |
| Punto de fusión | 531,15 K (258 °C) | |
| Propiedades químicas | ||
| Acidez | 2,33; 9,71 pKa | |
| Solubilidad en agua | 166,5 g/l | |
| Familia | Aminoácido | |
| Esencial | No | |
| Codón | GCU, GCC, GCA, GCG | |
| Punto isoeléctrico (pH) | 6,11 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
La Alanina (también conocida como Ala o A) es una de las piezas fundamentales que forman las proteínas en todos los seres vivos. Piensa en las proteínas como grandes cadenas, y la alanina es uno de los eslabones de esa cadena.
Aunque la alanina no es un aminoácido "esencial" para los humanos (lo que significa que nuestro cuerpo puede producirla), es muy importante para muchas funciones. Existe en dos formas, llamadas L-alanina y D-alanina. La L-alanina es la que se usa más comúnmente para construir proteínas en nuestro cuerpo. La D-alanina se encuentra en las paredes de las células de las bacterias y en algunas sustancias que combaten infecciones.
Contenido
Alanina: Un Bloque de Construcción Vital
La alanina es un aminoácido muy común. Es el segundo aminoácido más pequeño y se considera "hidrofóbico", lo que significa que no se mezcla bien con el agua. Se encuentra tanto dentro como fuera de las proteínas.
¿Qué es un Aminoácido?
Los aminoácidos son las unidades básicas que forman las proteínas. Imagina que las proteínas son como collares de perlas; cada perla es un aminoácido. Hay 20 tipos diferentes de aminoácidos que se usan para construir las proteínas en nuestro cuerpo.
Descubrimiento de la Alanina
La alanina fue descubierta por primera vez en el año 1850. Fue el químico alemán Adolph Strecker quien logró aislarla. Le dio el nombre de "alanina" a partir de la palabra "aldehído", que es un tipo de compuesto químico.
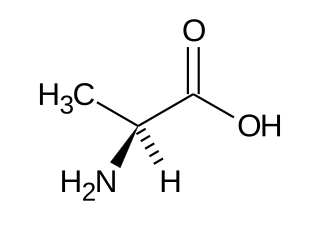
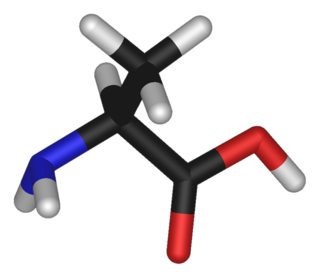
Estructura de la Alanina
La alanina tiene una estructura química particular. En su centro, tiene un átomo de carbono especial llamado "carbono alfa". A este carbono se le une un grupo llamado "metil" (-CH₃). Por esta razón, la alanina se clasifica como un aminoácido alifático.
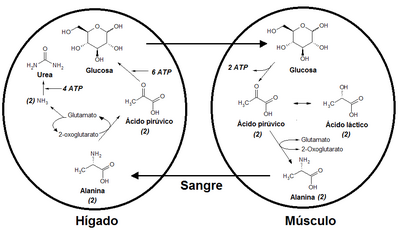
¿Cómo se Forma la Alanina en el Cuerpo?
Nuestro cuerpo puede fabricar alanina de forma sencilla. Esto ocurre a través de un proceso llamado "transaminación". En este proceso, un grupo químico llamado "amino" se transfiere a otra molécula llamada piruvato. Esta reacción es muy rápida y reversible.
Gracias a esto, la alanina participa en ciclos importantes de nuestro cuerpo, como:
- La glicólisis: el proceso para obtener energía del azúcar.
- La gluconeogénesis: el proceso para fabricar azúcar cuando lo necesitamos.
- El ciclo del ácido cítrico: otra forma de obtener energía.
¿Para Qué Sirve la Alanina?
Aunque el grupo metil de la alanina no es muy activo, la alanina es importante en las proteínas. Puede ayudar a las proteínas a reconocer otras moléculas o a ser específicas en sus funciones.
Además, la alanina juega un papel clave en cómo nuestro cuerpo maneja el azúcar. Ayuda a que el azúcar se use y se almacene correctamente.
¿Dónde Encontramos Alanina?
Podemos obtener alanina de muchos alimentos ricos en proteínas. Algunas buenas fuentes incluyen:
- Carne de res
- Carne de cerdo
- Pescado
- Huevos
- Productos lácteos (como la leche y el queso)
Véase también
 En inglés: Alanine Facts for Kids
En inglés: Alanine Facts for Kids