Hidróxido para niños
Un hidróxido es un tipo de compuesto químico que se forma cuando un átomo de hidrógeno en el agua (H2O) es reemplazado por un metal. Son muy importantes y se encuentran en muchas sustancias llamadas bases.
Antiguamente, a los hidróxidos de ciertos metales (como el sodio o el potasio) y del amonio se les llamaba "álcalis". Hoy en día, la palabra "álcali" se usa para cualquier sustancia que tenga propiedades alcalinas, es decir, que sea una base.
En la clasificación de los minerales, los hidróxidos suelen agruparse con los óxidos, aunque algunos expertos los consideran un grupo aparte.
Los hidróxidos se pueden clasificar en tres tipos:
- Básicos
- Anfóteros (que pueden actuar como ácido o como base)
- Ácidos
Por ejemplo, el hidróxido de zinc (Zn(OH)2) es anfótero. Esto significa que puede reaccionar tanto con ácidos como con bases.
Contenido
¿Qué es el ion hidróxido?
El ion hidróxido (OH−) es una partícula muy importante en química. Se forma de manera natural en el agua a través de un proceso llamado autoionización. Esto significa que algunas moléculas de agua se separan en iones de hidrógeno (H+) y iones hidróxido (OH−).
La cantidad de iones hidróxido en el agua pura es muy pequeña. El pH es una medida que nos dice si una solución es ácida, neutra o básica. El agua pura tiene un pH cercano a 7, que es neutro. Si una solución tiene más iones hidróxido, su pH será mayor a 7, lo que significa que es una base.
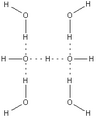
El ion hidróxido es una base porque puede aceptar un protón (un ion de hidrógeno) para formar una molécula de agua. También puede donar un par de electrones a otras sustancias. En el agua, los iones hidróxido se unen fuertemente a las moléculas de agua mediante enlaces especiales llamados enlaces de hidrógeno. Por eso, las soluciones concentradas de hidróxido de sodio son muy espesas.
Cuando el ion hidróxido está en una solución y entra en contacto con el dióxido de carbono del aire, reacciona rápidamente para formar otro ion llamado bicarbonato.
Las soluciones que contienen iones hidróxido pueden dañar el vidrio, por lo que los hidróxidos se guardan en recipientes de plástico sellados.
El ion hidróxido también puede unirse a átomos de metal para formar estructuras más grandes llamadas complejos. A veces, el hidróxido actúa como un "puente" entre dos átomos de metal.
¿Cómo se detectan los hidróxidos?
Los compuestos que tienen el grupo OH (hidroxilo) se pueden identificar usando una técnica llamada espectro infrarrojo. Estos compuestos muestran unas "señales" muy claras en el espectro, lo que facilita su detección. Si el grupo OH está formando enlaces de hidrógeno, la señal se vuelve más ancha.
Cuando el grupo OH está unido a un metal en un complejo, también se pueden observar otras señales específicas que ayudan a identificarlo.
¿Cómo se escriben las fórmulas de los hidróxidos?
Para escribir la fórmula de un hidróxido, primero se pone el símbolo del metal y luego el grupo OH (hidróxido). El grupo OH siempre tiene una carga de -1. Si el metal tiene una valencia (capacidad de combinación) mayor a 1, se coloca el grupo OH entre paréntesis y se le pone un subíndice igual a la valencia del metal.
Por ejemplo: Para formar hidróxido de hierro(III): Fe2O3 (óxido de hierro) + 3H2O (agua) → 2Fe(OH)3 (hidróxido de hierro(III))
Aquí, el hierro (Fe) tiene una valencia de 3, por eso el OH lleva un subíndice 3. La ecuación se "balancea" para que haya la misma cantidad de cada tipo de átomo en ambos lados.
Es importante no confundir el ion hidróxido (OH−) con el radical hidroxilo (OH•), que es diferente.
Las soluciones de hidróxidos en agua son básicas porque se separan en el ion del metal y los iones hidróxido. Esto ocurre porque el enlace entre el metal y el grupo hidróxido es de tipo iónico, mientras que el enlace entre el oxígeno y el hidrógeno dentro del grupo OH es covalente.
Por ejemplo: NaOH(aq) → Na+(aq) + OH- Esto significa que el hidróxido de sodio (NaOH) en agua se separa en iones sodio (Na+) e iones hidróxido (OH-).
Los hidróxidos se forman al combinar un óxido básico con agua. Estos compuestos son sustancias que, al disolverse, liberan iones hidróxido.
¿Cómo se nombran los hidróxidos?
La forma más común de nombrar los hidróxidos es usando la nomenclatura de Stock. Se usa la palabra "hidróxido" seguida del nombre del metal. Si el metal puede tener diferentes valencias, se indica su valencia con números romanos entre paréntesis.
Por ejemplo:
- Ni(OH)2 es el hidróxido de níquel (II) (el níquel tiene valencia 2).
- Ca(OH)2 es el hidróxido de calcio (el calcio tiene valencia 2, aunque en el ejemplo original se omitió el subíndice 2, lo correcto es Ca(OH)2).
Sales básicas que contienen hidróxido
A veces, los hidróxidos forman parte de otras sales, creando lo que se conoce como sales básicas. Por ejemplo, la malaquita es un mineral que es un carbonato básico. Su fórmula, Cu2CO3(OH)2, muestra que contiene tanto carbonato como hidróxido de cobre. Otro ejemplo es la atacamita, un cloruro básico con la fórmula Cu2Cl(OH)3.
La cerusa es un carbonato de plomo básico, (PbCO3)2·Pb(OH)2. Se usaba como pigmento blanco, pero su uso ahora está limitado por razones de seguridad.
Usos de los hidróxidos
Las soluciones de hidróxido de sodio, también conocidas como lejía o sosa cáustica, son muy importantes en la industria. Se usan para fabricar papel, textiles, para tratar el agua potable, en la producción de jabones y detergentes, y como limpiadores de desagües. Se producen millones de toneladas cada año.
Cuando una sal de un ácido débil se disuelve en agua, también puede generar iones hidróxido. El carbonato de sodio se usa como una base, por ejemplo, en la limpieza. Aunque es menos fuerte que el hidróxido de sodio, es útil porque es un sólido.
Minerales como la bauxita (un hidróxido de aluminio) son la principal fuente para obtener el metal aluminio. De manera similar, la goethita y la lepidocrocita (hidróxidos de hierro) son minerales importantes para producir hierro.
Galería de imágenes
-
Gráfico del anión hidróxido.
Véase también
 En inglés: Hydroxide Facts for Kids
En inglés: Hydroxide Facts for Kids
- Grupo hidroxilo
- Hidróxido de litio
- Hidróxido de potasio
- Hidróxido de sodio
- Hidróxido de calcio
- Hidróxido de magnesio
- Hidróxido de bario
- Hidróxido de hierro(II)
- Hidróxido de aluminio
- Hidróxido de cobre(II)
- Hidróxido de níquel(II)
- Hidróxido de estroncio
- Hidróxido de torio
- Hidróxido de amonio
- Ácido
- Sales