Hexafluoruro de xenón para niños
Datos para niños
Hexafluoruro de Xenón |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Hexafluoruro de xenón | ||
| General | ||
| Fórmula estructural | 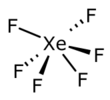 |
|
| Fórmula molecular | XeF6 | |
| Identificadores | ||
| Número CAS | 13693-09-9 | |
| ChemSpider | 123066 | |
| PubChem | 139546 | |
| UNII | WXC3I4P46T | |
|
F[Xe](F)(F)(F)(F)F
|
||
|
InChI
InChI=1S/F6Xe/c1-7(2,3,4,5)6
Key: ARUUTJKURHLAMI-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Densidad | 3560 kg/m³; 3,56 g/cm³ | |
| Masa molar | 169,29 g/mol | |
| Punto de fusión | 322,4 K (49 °C) | |
| Punto de ebullición | 348,8 K (76 °C) | |
| Estructura cristalina | Octaédrica | |
| Propiedades químicas | ||
| Solubilidad en agua | reacciona con agua | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0sólido | -294 kJ/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El hexafluoruro de xenón es un compuesto químico muy interesante. Su fórmula es XeF6. Es uno de los tres fluoruros que se forman con el xenón, un tipo de gas noble. Los otros dos son el difluoruro de xenón y el tetrafluoruro de xenón. Todos estos compuestos son estables a temperaturas normales. El XeF6 es el más fuerte de ellos para añadir flúor a otras sustancias. Es un sólido que no tiene color, pero se convierte fácilmente en un vapor de color amarillo intenso.
Contenido
¿Cómo se obtiene el hexafluoruro de xenón?
El hexafluoruro de xenón se puede crear calentando difluoruro de xenón (XeF2) a unos 300 °C. Esto se hace bajo una presión alta de gas flúor.
El papel de los catalizadores
Si se usa un catalizador como el NiF2, esta reacción puede ocurrir a una temperatura más baja, alrededor de 120 °C. Un catalizador es una sustancia que ayuda a que una reacción química ocurra más rápido o a una temperatura diferente, sin ser consumida en el proceso.
¿Cómo es la estructura del XeF6?
Descubrir la forma del XeF6 fue un desafío para los científicos. A diferencia de otros compuestos de xenón, su estructura no es tan sencilla.
La forma en estado gaseoso
Cuando el XeF6 está en estado gaseoso, cada molécula es individual. Los científicos usan la teoría VSEPR para predecir su forma. Esta teoría sugiere que, debido a sus seis átomos de flúor y un par de electrones "solitarios", la molécula no tiene una forma perfectamente octaédrica.
Una molécula que cambia de forma
De hecho, estudios avanzados muestran que es una molécula "fluxional". Esto significa que su forma puede cambiar o "fluctuar" muy fácilmente. Es como si la molécula no pudiera decidirse por una forma fija.
La estructura en solución
Cuando el XeF6 se disuelve, forma una estructura de cuatro moléculas unidas, como un grupo. En este grupo, los átomos de flúor se mueven e intercambian posiciones constantemente, como los dientes de un engranaje.
Diferentes formas sólidas
Se conocen seis formas diferentes en las que el XeF6 puede existir como sólido. Una de estas formas contiene iones especiales llamados XeF+
5 y F−
.
¿Cómo reacciona el hexafluoruro de xenón?
El XeF6 es un compuesto muy reactivo y puede participar en varias reacciones químicas.
Reacción con agua (Hidrólisis)
Cuando el hexafluoruro de xenón entra en contacto con agua, reacciona en varios pasos. Al final, produce trióxido de xenón (XeO3) y ácido fluorhídrico (HF).
- Paso 1: XeF
6 + H
2O → XeOF
4 + 2 HF - Paso 2: XeOF
4 + H
2O → XeO
2F
2 + 2 HF - Paso 3: XeO
2F
2 + H
2O → XeO
3 + 2 HF - Reacción total: XeF
6 + 3 H
2O → XeO
3 + 6 HF
Reacciones con iones fluoruro
El XeF6 puede actuar como un ácido de Lewis, lo que significa que puede aceptar uno o dos iones fluoruro (F-).
- Si acepta un ion fluoruro: XeF
6 + F−
→ XeF−
7 - Si acepta dos iones fluoruro: XeF−
7 + F−
→ XeF2−
8
Formación de octafluoroxenatos
Las sales que contienen el ion XeF2−
8 (llamadas octafluoroxenatos) son muy estables. Se descomponen solo a temperaturas muy altas, por encima de los 400 °C.
- Las sales de sodio y potasio se forman directamente:
- 2 NaF + XeF
6 → Na
2XeF
8 - 2 KF + XeF
6 → K
2XeF
8
- 2 NaF + XeF
- Las sales de cesio y rubidio se forman en dos pasos. Primero se crean otras sales, que luego se calientan para obtener los octafluoroxenatos amarillos:
- 2 CsF + XeF
6 → CsXeF
7 - 2 CsXeF
7 → Cs
2XeF
8 + XeF
6 - 2 RbF + XeF
6 → RbXeF
7 - 2 RbXeF
7 → Rb
2XeF
8 + XeF
6
- 2 CsF + XeF
Estas sales también reaccionan con el agua, formando diferentes productos que contienen xenón y oxígeno.
Reacciones con aceptores de flúor
El XeF6 también reacciona con sustancias que aceptan flúor de forma fuerte, como el Pentafluoruro de rutenio (RuF
5). En estas reacciones, se forma un ion especial llamado XeF+
5.
- XeF
6 + RuF
5 → XeF
5RuF
6
Véase también
 En inglés: Xenonhexafluoride Facts for Kids
En inglés: Xenonhexafluoride Facts for Kids

