Geometría molecular para niños
La geometría molecular es como el "plano" o la forma que tienen las moléculas en el espacio. Imagina que los átomos son pequeñas bolitas y los enlaces químicos son los palitos que las unen. La geometría molecular nos dice cómo se organizan esas bolitas y palitos en tres dimensiones.
Esta forma es muy importante porque determina muchas de las características de una molécula, como qué tan fácil reacciona con otras, si es "polar" (como un imán con un lado positivo y otro negativo), en qué estado se encuentra (sólido, líquido o gas), su color, y cómo funciona en los seres vivos.
Hoy en día, la teoría más usada para predecir la forma de las moléculas se llama Teoría de Repulsión de Pares de Electrones de Valencia (TRPEV). Es muy útil porque ayuda a los científicos a entender y predecir cómo se verán las moléculas.
Contenido
¿Cómo se descubre la forma de una molécula?
Para saber la forma exacta de una molécula, los científicos suelen estudiarlas a temperaturas muy bajas, casi llegando al cero absoluto. Esto es porque a temperaturas más altas, las moléculas se mueven y giran mucho, lo que dificulta ver su forma real.
Cuando las moléculas están en estado sólido, se puede usar una técnica llamada difracción de rayos X. Es como tomar una "foto" de la molécula usando rayos X para ver dónde está cada átomo. También se pueden usar cálculos especiales en computadoras, basados en las reglas de la mecánica cuántica, para predecir su forma.
La posición de cada átomo en una molécula depende de cómo está unido a sus vecinos. Para describir la geometría, se usan tres medidas principales:
- Longitud de enlace: Es la distancia entre los centros de dos átomos que están unidos.
- Ángulo de enlace: Es el ángulo que forman tres átomos conectados.
- Ángulo de torsión: Es el ángulo entre tres enlaces seguidos.
El movimiento de los átomos
Aunque las moléculas tienen una forma definida, sus átomos nunca están completamente quietos. Siempre están en movimiento, incluso a temperaturas muy bajas. Estos movimientos son de varios tipos:
- Traslación: La molécula se mueve de un lugar a otro.
- Rotación: La molécula gira sobre sí misma.
- Vibración: Los átomos dentro de la molécula se mueven como si estuvieran unidos por resortes, oscilando alrededor de su posición normal.
Incluso a la temperatura más fría posible (cero absoluto), los átomos siguen vibrando un poco. A temperaturas más altas, estas vibraciones pueden ser más rápidas, pero la molécula mantiene su forma general. Los científicos usan técnicas especiales, como la espectroscopia, para estudiar estos movimientos y entender mejor la geometría molecular.
¿Qué son los isómeros?
Los isómeros son moléculas que tienen la misma cantidad y tipo de átomos (la misma fórmula química), pero están organizadas de manera diferente en el espacio. Esto hace que, aunque tengan los mismos "ingredientes", sus propiedades sean muy distintas.
- Isómeros estructurales: Tienen los mismos átomos, pero conectados en un orden diferente. Por ejemplo, dos moléculas con la misma cantidad de carbono e hidrógeno pueden tener formas muy distintas si los átomos están unidos de otra manera.
- Estereoisómeros: Tienen los mismos átomos conectados en el mismo orden, pero su orientación en el espacio es diferente. A veces, una de estas moléculas es como la imagen en un espejo de la otra, pero no se pueden superponer. Esto es muy común en las moléculas de los seres vivos y puede hacer que una versión funcione de una manera y la otra no.
- Plegamiento de proteínas: Las proteínas son moléculas muy grandes y complejas que pueden adoptar muchas formas diferentes. Su forma es crucial para que puedan cumplir sus funciones en el cuerpo.
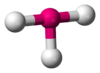
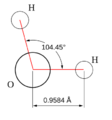
Un ejemplo sencillo es la molécula de agua (H2O). Tiene un átomo de oxígeno en el centro y dos átomos de hidrógeno unidos a él. Estos átomos no están en línea recta, sino que forman un ángulo de aproximadamente 104.5 grados, dándole una forma de "V" o angular.
Formas comunes de las moléculas
Las moléculas pueden tener muchas formas diferentes, dependiendo de cuántos átomos tengan y cómo estén unidos. Aquí te mostramos algunas de las formas más comunes:
| Tipo de molécula | Forma | Disposición electrónica† | Angulación | Geometría‡ | Ejemplos |
|---|---|---|---|---|---|
| H | Molécula diatómica | = 180° | HF, O2, CO | ||
| AX2E0 | Lineal | = 180° | BeCl2, HgCl2, CO2, PbCl2 | ||
| AX2E1 | Angular | ≈ 120° | NO2−, SO2, O3 | ||
| AX2E2 | Angular forma "V" | ≈ 104,45º | H2O, OF2, SCl2 | ||
| AX2E3 | Lineal | = 180° | XeF2, I3− | ||
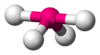
| AX3E0 | Trigonal plana | = 120° | BF3, CO32−, NO3−, SO3 | ||
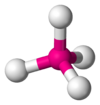
| AX3E1 | Trigonal Piramidal | ≈107,3º | NH3, PCl3 | ||
| AX3E2 | Forma de T | = 90°,180° | ClF3, BrF3 | ||
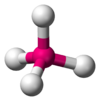
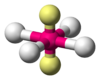
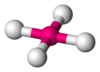
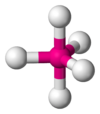
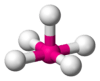
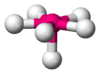
| AX4E0 | Tetraédrica | ≈ 109,5º | CH4, PO43−, SO42−, ClO4− | ||
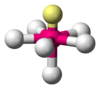
| AX4E1 | Balancín | = 90°, 120°, 180° | SF4 | ||
| AX4E2 | Cuadrada plana | = 90°, 180° | XeF4 | ||
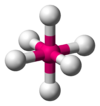
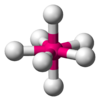
| AX5E0 | Bipirámide trigonal | = 90°, 120°, 180° | PCl5 | ||
| AX5E1 | Pirámide cuadrangular | ≈ 90°, 180° | ClF5, BrF5 | ||
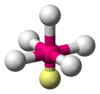
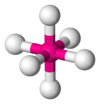
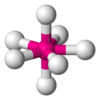
| AX6E0 | Octaédrica | = 90°, 180° | SF6 | ||
| AX6E1 | Pirámide pentagonal | = 72°, 90°, 180° | XeOF— 5, IOF2- 5 |
||
| AX7E0 | Bipirámide pentagonal | = 72°, 90°, 180° | IF7 |
† Disposición electrónica incluyendo los pares no enlazantes (mostrados en amarillo)
‡ Geometría observada (excluyendo los pares no enlazantes)
Galería de imágenes
Véase también
 En inglés: Molecular geometry Facts for Kids
En inglés: Molecular geometry Facts for Kids