Trifluoruro de bromo para niños
Datos para niños
Trifluoruro de bromo |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Fórmula molecular | BrF3 | |
| Identificadores | ||
| Número CAS | 7787-71-5 | |
| ChemSpider | 22996 | |
| PubChem | 24594 | |
| UNII | BD697HEL7X | |
| Propiedades físicas | ||
| Apariencia | líquido de color pajizo | |
| Densidad | 2803 kg/m³; 2,803 g/cm³ | |
| Masa molar | 136,90 g/mol | |
| Punto de fusión | 8,77 °C (282 K) | |
| Punto de ebullición | 125,72 °C (399 K) | |
| Índice de refracción (nD) | 1,4536 | |
| Propiedades químicas | ||
| Momento dipolar | 1,19 D | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
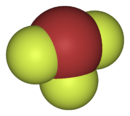
El trifluoruro de bromo es un compuesto químico especial que combina bromo y flúor. Su fórmula química es BrF3. Es un líquido de color amarillo claro con un olor fuerte.
Este compuesto es muy reactivo. Reacciona de forma muy fuerte con el agua y con muchas sustancias orgánicas. También es un disolvente inorgánico, lo que significa que puede disolver otras sustancias que no son orgánicas. Se usa para crear hexafluoruro de uranio (UF6), un material importante en la producción de energía nuclear.
Contenido
¿Cómo es el trifluoruro de bromo?
El trifluoruro de bromo es un líquido que libera vapores. Es muy reactivo y puede dañar la piel si entra en contacto con ella. Incluso materiales como el cuarzo y otros silicatos pueden ser afectados por él a temperaturas bajas, como 30 °C.
Este compuesto absorbe el agua y reacciona con ella. Puede disolverse en ácido sulfúrico concentrado. Además, puede conducir la electricidad y disolver otros compuestos llamados fluoruros.
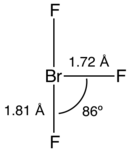
La forma de la molécula
La molécula de trifluoruro de bromo tiene una forma particular, como una letra "T". Esto es similar a otras moléculas como el trifluoruro de cloro y el trifluoruro de yodo.
En esta molécula, la distancia entre el átomo de bromo y los átomos de flúor de los extremos es de 181 picómetros (pm). La distancia al átomo de flúor del medio es de 172 pm. El ángulo entre el flúor del medio y los flúor de los extremos es de 86,2 grados.
¿Cómo se obtiene el trifluoruro de bromo?
El trifluoruro de bromo se puede obtener haciendo reaccionar flúor frío con bromo.
El científico Paul Lebeau fue el primero en describir este material en 1906. Él lo obtuvo al hacer reaccionar bromo con flúor a una temperatura de 20 °C. La reacción se ve así:
Si se usa flúor caliente en lugar de frío, se produce otro compuesto llamado pentafluoruro de bromo.
También es posible obtener trifluoruro de bromo a partir de monofluoruro de bromo. Esto ocurre en una reacción donde el monofluoruro de bromo se transforma en trifluoruro de bromo y bromo:
¿Cómo reacciona el trifluoruro de bromo?
El BrF3 reacciona muy rápido y libera mucho calor cuando entra en contacto con el agua. En esta reacción, se forman ácido bromhídrico y ácido fluorhídrico. La ecuación de esta reacción es:
El BrF3 es un agente fluorante, lo que significa que puede añadir átomos de flúor a otras sustancias. Sin embargo, es menos reactivo que el ClF3.
El líquido de trifluoruro de bromo puede conducir la electricidad. Esto se debe a que algunas de sus moléculas se separan en iones, en un proceso llamado autoionización:
- 2 BrF3 ⇌ BrF2+ + BrF4−
Muchos fluoruros que tienen iones se disuelven fácilmente en BrF3, formando nuevos iones llamados fluoroaniones:
Otros fluoruros, que son covalentes, también pueden reaccionar con BrF3. En este caso, actúan como "aceptores de fluoruro", lo que los hace comportarse como ácidos en este disolvente:
Otros compuestos relacionados
- Monocloruro de bromo
- Dióxido de bromo
Véase también
 En inglés: Bromine trifluoride Facts for Kids
En inglés: Bromine trifluoride Facts for Kids


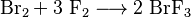
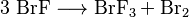
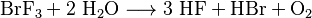
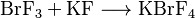
![\mathrm{BrF_3 + SbF_5 \longrightarrow [BrF_2^{+}][SbF_6^{-}]}](/images/math/1/5/0/150ec4f4e52d2e0fb9572b675aa78382.png)